KAT 141
1. PERHITUNGAN STOIKIOMETRI
Stoikiometri ~ digunakan bagi spesies yang bertindak balas;
merupakan hubungan berat antara spesies kimia
yang bertindak balas; atau berhubung dengan nisbah bahan kimia yang
bertindak balas.
Beberapa Konsep Asas
![]() Jisim
atom relatif berat gram-atom
Jisim
atom relatif berat gram-atom
![]() Jisim
formula relatif berat gram-formula
Jisim
formula relatif berat gram-formula
![]() Jisim
molekul relatif berat gram-molekul.
Jisim
molekul relatif berat gram-molekul.
mol
-
Unit asas agi
menerangkan jumlah spesies kimia.
mol =
berat (g)
.
berat formula (g/mol)
=
berat (g)
.
jisim formula relatif
=
berat (g)
.
jisim molekul relatif
mmol atau milimol =
berat (g)
.
jisim molekul relatif
*Jisim molekul relatif (JMR) akan digunakan.
Kepekatan Larutan
Dinyatakan dalam
kemolaran, kenormalan, peratus berat per berat, peratus berat per isipadu, ppm
dan lain-lain.
Kemolaran atau
Kepekatan Molar (M)
Kepekatan molar
suatu larutan diberikan oleh :
Kemolaran =
bil mol =
bil mol .
Isipadu (L) Isipadu (mL)
Contoh :
Berapa berat (g) Na2SO4 yang diperlukan untuk
menyediakan 500 mL larutan 0.100 M?
Penyelesaian :
0.100
M =
0.100 mmol = berat
(mg)/J.M.R.
mL 500 mL
berat
Na2SO4 = 0.100
mmol x 500 mL x 142 mg .
mL mmol
= 7.10 g
Kenormalan
(N)
Kenormalan suatu larutan
diberikan oleh perhubungan :
Kenormalan
= bil. Setara kimia (eq)
Isipadu
(L)
= bil. Setara kimia (meq.)
Isipadu
(mL)
Bil setara
(eq.) = berat (g) .
berat
setara (g/eq.)
Berat
setara = JMR (g/mol) .
bil. Unit yang bertindak balas (eq/mol)
Bil setara (eq.) = berat (g) .
berat
setara (g/eq.)
= Kenormalan
(eq/L) x isipadu (L)
Bil setara
(Meq.) = berat (mg) .
berat
setara (mg/meq.)
= Kenormalan
(meq/mL) x isipadu mL)
Unit yang
bertindak balas :
|
Jenis tindak
balas |
Unit bertindak
balas |
|
Assid-bes Redoks |
H+ elektron |
Contoh :
Kira berat setara (a) NH3 (b) H2C2O4
(dalam tindak balas dengan NaOH).
Penyelesaian :
(a)
NH3
Berat setara = ![]()
(b)
H2C2O4 (dalam tindak balas dengan NaOH
Berat setara =
![]()
=
45.03 g/eq
Contoh :
Kira kenormalan larutan :
(a) 5.300
g/L Na2CO3 (apabila
CO32-
bertindak balas dengan dua H+ )
(b) 5.267
g/L K2Cr2O7 (Cr diturunkan kepada Cr3+).
Penyelesaian :
(a)
CO32+ bertindak balas dengan 2H+ menghasilkan H2CO3.
Kenormalan =
5.200 g/L . =
0.100 eq/L = 0.100 N
105.99/2 g/eq
(b)
Setiap Cr(IV) diturunkan kepada Cr2+ ; jumlah
perubahan 6e-/molekul K2Cr2O7.
Cr2O72- +
14H+ + 6e- ![]() 2Cr23+ + 7H2O
2Cr23+ + 7H2O
Kenormalan =
5.267 g/L =
0.1074 eq/L = 0.1074 N
294.19/6 g/eq
Contoh : Kira isipadu HCl pekat yang diperlukan untuk menyediakan 100 mL 6.0 M HCl daripada botol reagen HCl
pekat. Label pada botol dituliskan HCl
37% dan ketumpatan ialah 1.18 g/mL .
Penyelesaian 37%
= 37 g HCl
.
100 g
larutan pekat
Ketumpaptan = 1.18 g/mL
Berat
HCl . =
1.18 g larutan pekat x 37 g HCl .
Isipadu HCl mL larutan pekat 100 g larutan pekat
= 21.9 g
Isipadu HCl
pekat yang diperlukan :
= 21.9 g HCl .
= 50.2 mL
0.437 g HCl/mL
Ungkapan Keputusan Analisis :
unit.
Unit berat bagi
analisis makro (banyak) adalah dalam
gram (g). Bagi kandungan surihan
(trace)/sedikit : unit berat adalah mg(10-3 g), mg(10-6
g), ng(10-9 g). Unit asas
isipadu adalah liter (L). Unit
lain mL (10-3 L), mL(10-6
L).
Sampel Pepejal
Kepekatan dinyatakan dalam peratus berat (% w/w).
Contoh :
Sampel batu kapur seberat 1.267 g dan mengandungi 0.3684 g Fe. Kira % Fe.
Penyelesaian :
% Fe = 0.3684 g x 100%
= 29.08%
1.267 g
% (w/w) = berat zat terlarut (g) x
100% = 29.08%
berat sampel (g)
Bagi kepekatan surihan, ia dinyatakan dalam unit yang
lebih kecil : bahagian dalam seribu
(ppt); bahagian dalam sejuta (ppm);
bahagian dalam seribu juta (ppb).
ppt (w/w) = berat
zat terlarut (g) x 103
berat sampel (g)
ppm (w/w) = berat
zat terlarut (g) x 106
berat sampel (g)
ppb (w/w) = berat
zat terlarut (g) x 109
berat sampel (g)
Contoh : Sampel seberat 2.6 g mengandungi 3.6 mg Zn.
3.6
mg =
1.4 mg =
1.4 mg
2.6 g g Kg
3.6x103
ng =
1.4x103 ng
= 1.4103 mg =
14.00 ppb.
2.6 g g Kg
Sampel Cecair
Dinyatakan dalam
unit berat/isipadu. Jika analit ialah
cecair dan dilarutkan dalam cecair lain, kepekatan dinyatakan dalam unit
isipadu/isipadu (v/v).
% (w/v) = berat zat terlarut (g) x
100
Isipadu sampel (mL)
ppt (w/v) = berat
zat terlarut (g) x 103
Isipadu sampel (mL)
ppm (w/v) = berat
zat terlarut (g) x 106
Isipadu sampel (mL)
ppb (w/v) = berat
zat terlarut (g) x 109
Isipadu sampel (mL)
Contoh : Kepekatan
Ca dalam air mineral ialah 2
ppm.
2 ppm = 2 mg = 2 mg
mL L
* Jika cecair
dilarutkan dalam pelarut (cecair),
kepekatan dinyatakan dalam isipadu
(isipadu v/v).
Unit yang biasa
bagi kepekaran surihan :
Unit
|
Singkatan |
w/w |
w/v |
v/v |
|
Bhg. Dalam
sejuta |
ppm |
mg/kg |
mg/L |
mL/L |
|
|
|
mg/g |
mg/mL |
nL/mL |
|
Bhg. Dalam
sebilion |
ppb |
mg/kg |
mg/L |
nL/L |
|
|
|
ng/g |
ng/mL |
pL/mL |
Contoh : Kira kepekatan molar larutan 1.00 ppm Li dan
kira berat Pb(NO3)2 yang diperlukan untuk menyediakan 100 ppm larutan Pb2+ .
(a) [Li]
= 1.00 ppm =
1.00 mg/L
MLi = 1.00
mg/L x 10-3 g/mg = 1.44x10-4 mol/L
6.94 g
Li/mol
(b) 100 ppm Pb2+ =
100 mg/L = 0.100 g/L
1
L =
0.100 g Pb2+ = 4.83x10-4
mol Pb
207 g/mol
Berat Pb(NO3)2 =
4.83x10-4 mol x 331.2 g/mol
= 0.160 g
atau :
Pencairan :
Pencairan dibuat daripada larutan stok yang lebih
pekat. Bil. mol (mmol) larutan stok yang diambil untuk
pencairan adalah sama dengan bil. mol (mmol) larutan yang telah dicairkan.
Mstok x mLstok = Mdicair x mLdicair
ANALISIS VOLUMETRI : PENGIRAAN
STOIKIOMETRI
Analisis
volumetrik atau titratan (pentitratan)
merupakan salah satu teknik analisis yang paling berguna dan jitu (accurate)
. Ianya cepat dan dapat diautomasikan
dan dapat digunakan bagi analit yang sedikit.
Prinsip pentitratan
Dalam
pentitratan, bahan yang diuji bertindak balas dengan reagen yang ditambahkan
iaitu larutannya telah diketahui
kepekatannya. Larutan ini dikenali
sebagai larutan piawai-biasanya dimasukkan dalam buret. Larutan yang ditambah (daripada buret)
dikenal sebagai titran (penitrat).
Keperluan Pentitratan
(i)
Tindak balas mesti stoikiometri.
(ii)
Tindak balas mestilah cepat.
(iii)
Tiada tindak balas sampingan dan tindak balas mestilah
spesifik.
(iv)
Mestilah terdapat pertukaran yang nyata dalam sifat larutan
apabila tindak balas telah sempurna.
(v)
Tindak balas mestilah kuantitatif –keseimbangan tindak balas
mestilah mengarah ke kanan supaya berlaku pertukaran pada takat akhir.
(vi)
Takat akhir mestilah sama dengan takat kesetaraan.
Pengkelasan Kaedah Pentitratan
(i)
Pentitratan asid-bes
(ii)
Pentitratan pemendakan.
(iii)
Pentitratan kompleksometri.
(iv)
Pentitratan pengoksidaan-penurunan (redoks).
Pengiraan Berhubung dengan Kaedah Pentitratan
Peratus analit A
yang bertindak balas berasaskan nisbah
1:1 dengan titran dikira
berdasarkan :
%
A =
pecahan analit x 100%
= mg analit x 100%
mg sampel
= mmol x
JMR analit (mg/mmol) x 100 %
mg sampel
= Mtitran(mmol/mL)
x mLtitran x
JMR x 100 %
mg sampel
Contoh :
Sampel seberat 0.4671 g megandungi
NaHCO3 dilarutkan dan dititrat dengan 0.1067 M larutan piawai
HCL memerlukan 40.72 mL.
Tindak balas
: HCO-3 + H+ ![]() H2O + CO2
H2O + CO2
Kira
peratus NaHCO3 dalam sampel.
Penyelesaian :
mmol H+ =
0.1067 mmol/mL x 40.72 mL
= 4.3448
mmol = mmol NaHCO2
mg NaHCO3 =
4.3448 mmol/mL x 84.01 mg/mmol
= 365.01 mg
% NaHCO3 = 4.3448 mmol/mL x 100%
467.1 mg sampel
= 78.14% mg
atau :
% NaHCO3 = MHCl x mLHCl
x JMR NaHCO3 x 100%
mg sampel
= 0.1067
mmol/mL x 40.72 mL x 84.01 mg/mmol x
100%
467.1 mg
=
78.14%
Apabila bahan tidak bertindak balas dengan nisbah 1:1,
factor pemindahan (conversion) digunakan.
![]() aA +
tT P
aA +
tT P
mmol A = mmol
T x ![]() (mmol A/mmol T)
(mmol A/mmol T)
mmol A = MT x ![]() x mLT x
x mLT x ![]() (mmol A/mmol T)
(mmol A/mmol T)
mg A = mmol A x JMR A
(mg/mmol)
atau :
mg A = MT x ![]() x mLT (mL) x
x mLT (mL) x ![]()
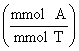
x JMR A ![]()
Contoh
: Sampel abu soda seberat 0.2638 g dianalisis dengan mentitrat Na2CO3 dengan 0.1288 M larutan piawai HCL memerlukan
38.27 mL. Tindak balas
ialah :
![]() CO32- +
2H+ H2O + CO2
CO32- +
2H+ H2O + CO2
Kira peratus Na2CO3 dalam sampel.
Penyelesaian :
mmol
Na2CO3 = ˝ mmol asid
(tindak balas nisbah 1:2)
mmol H+ =
0.1288 mmol/mL x 38.27 mL = 4.929 mmol
mmol CO32- = 4.929 mmol H+ x ˝ 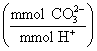
= 2.4645 mmol
mg Na2CO3 = 2.4645 mmol/mL
x 105.99 mg
Na2CO3
mmol
=
261.21 mg
% Na2CO3 = 261.21 mmol Na2CO3 x
100%
263.8 mg sampel
=
99.02%
Pempiawaian
Apabila tiada
bahan pentitrat yang berketulenan tinggi, kepekatan pentitrat yang hampir
kepekatan sebenar mestilah ditentukan dengan jitu dengan cara pempiawaian. Ini dilakukan dengan mentitrat kuantiti
piawai primer yang ditimbang. Daripada
isipadu titran yang digunakan untuk mentitrat piawai primer, kepekatan dapat
dikira.
mmol bahan piawai = mg
bahan piawai .
JMR bahan piawai (mg/mmol)
mmol titran
= Mtitran(mmol/mL)
x mLtitran
= mmol bahan piawai x 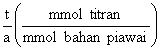
Mtitran ![]() =
= 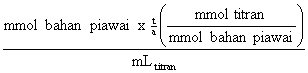
atau :
Mtitran ![]() =
= ![]()
Contoh : Kira-kira 0.1 M larutan HCl disediakan dengan
pencairan 120 kali HCl pekat. Ia
dipiawaikan dengan mentitratkan 0.1876 g piawai primer,
Na2CO3 kering.
![]() CO32- +
2H+ H2O + CO2
CO32- +
2H+ H2O + CO2
Pentitratan memerlukan 35.86 mL asid.
Kira kepekatan molar HCl.
Penyelesaian :
mmol H+ = 2 mmol Na2CO3
mmol Na2CO3 =
187.6 mg . =
1.770 mmol
105.99 mg (mmol)
mmol HCl
= MHCl x 35.86 mL
=
![]()
MHCl =
1.770 mmol x 2 mmol HCl/mmol Na2CO3
35.86 mL
= 0.09872 M
atau :
MHCl =
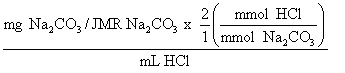 .
.
= ![]()
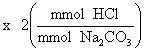
= 0.0987 M
Pentitratan Balik
Kadangkala
tindak balas adalah perlahan untuk capai kesempurnaan dan takat akhir yang
tajam tidak diperoleh. Dengan itu
pentitratan balik adalah berguna. Dalam
teknik ini sejumlah tertentu reagen
(titran) ditambah kepada sampel dengan sedikit berlebihan. Jumlah reagen yang berlebihan ditentukan
dengan pentitratan dengan larutan piawai lain.
mmol reagen
bertindak balas = mmol diambil – mmol dititrat balik
mg analit =
mmol reagen bertindak balas
x faktor 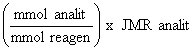
Perhubungan Berat : Analisis Gravimetri
Dalam analisis
gravimetri, analit (bahan larut) ditukar kepada bentuk tak melarut
(mendakan) yang kemudian ditimbang.
Daripada berat mendakan yang terbentuk dan perhubungan berat antara
analit dengan mendakan, kita dapat menentukan berat analit.
Contoh :
Analisis % Cl dalam sampel dengan cara menimbang AgCl.
![]() reagen pemendakan
reagen pemendakan
![]() Cl- AgCl
Cl- AgCl
![]() 1
mol Cl- 1 mol AgCl
1
mol Cl- 1 mol AgCl
g Cl- . = JAR Cl(g Cl/mol Cl) . x 1 mol
Cl .
g AgCl JMR
AgCl (g AgCl/mol AgCl) 1 mol
AgCl
g Cl- = g AgCl
x JAR Cl . (g Cl/g AgCl)
JMR AgCl
Contoh :
Analisis % Cl2 dalam sampel dengan cara
menimbang AgCl.
![]() reagen pemendakan
reagen pemendakan
![]() Cl- 2AgCl
Cl- 2AgCl
(Ag+)
g Cl2 . = JMR Cl2 (g Cl2 / mol Cl2 ) .
x 1 mol Cl2 .
g AgCl JMR
AgCl (g AgCl/mol AgCl)
2 mol AgCl2
g Cl2 = g AgCl
x JMR Cl2 . (g Cl 2 /g AgCl)
2 JMR AgCl
Contoh :
Pb2+
![]() Cl2 PbCl2
Cl2 PbCl2
![]() 1 mol Cl2 1 mol PbCl2
1 mol Cl2 1 mol PbCl2
g Cl2 = g PbCl2 x JAR Cl2 . (g Cl2 /g PbCl2 )
JMR PbCl2
atau :
Secara am :
g bahan yang
ditentukan = berat mendakan x factor gravimetri.
Faktor gravimetri =
JMR bahan yang ditnetukan x a
JMR mendakan b
a dan b :
angka bulat yang membuatkan JMR atau JAR pengatas dan pembawah dalam
keadaan kestabilan.
Bagi contoh di
atas :
Faktor gravimetri =
JAR Cl . x 1
JMR AgCl 1
JAR Cl2 . x 1
JMR AgCl 2
Contoh : Kira berat Ba dan
Cl yang terdapat 25.0 g BaCl2
Penyelesaian :
Berat Ba =
25.00 BaCl2 x 1 mol Ba
. x JAR Ba
.
1 mol BaCl2 JMR BaCl2
=
25.0 g x 1 mol Ba
. x 137.3 g/mol .
1 mol BaCl2 208.2 g/mol
= 16.5 g Ba
Berat Cl =
25.0 g BaCl2 x 2 mol
Cl . x 35.45 g/mol .
1 mol BaCl2 208.2 g/mol
= 8.51 g Cl
Contoh :
|
Bahan ditentu (sought) |
Mendakan (weighed) |
Faktor gravimetri |
|
SO3 |
BaSO4 |
1 x
JMR SO3 . 1 JMR BaSO4 |
|
Fe3O4 |
Fe2O3 |
2 x
JMR Fe3O4 . 3 JMR Fe2O3 |
|
P2O5 |
Mg2
P2O7 |
1 x
JMR P2O5 . 1 JMR Mg2 P2 O7 |
Previous
| Next