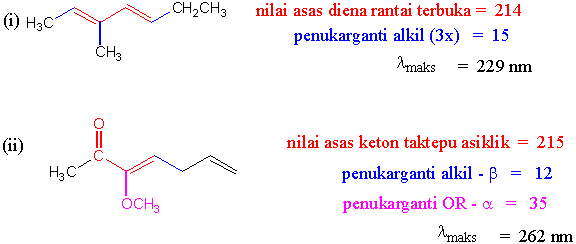
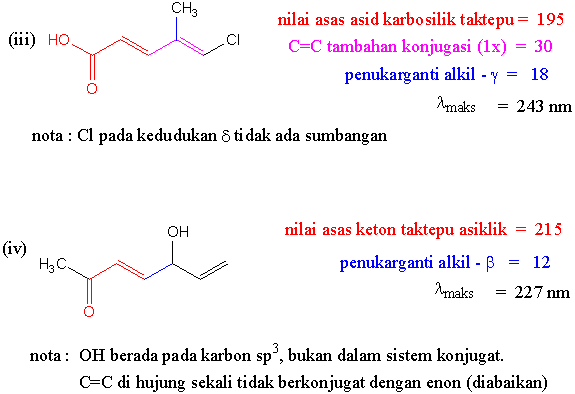
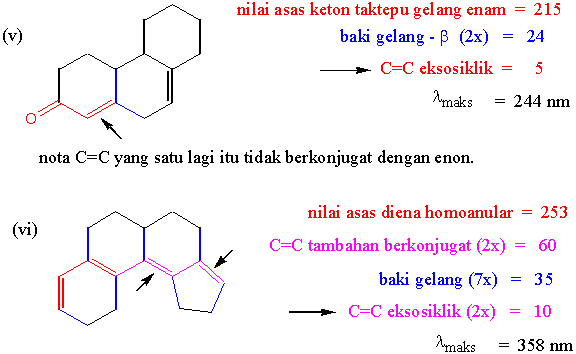
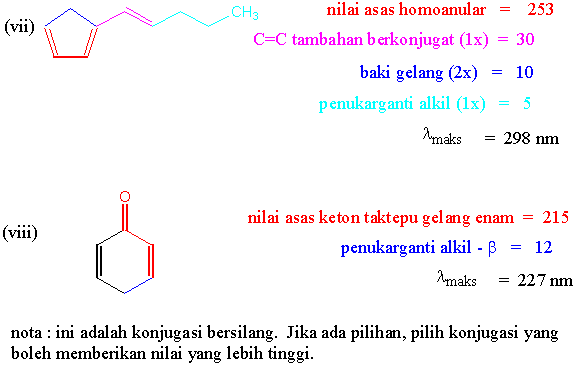
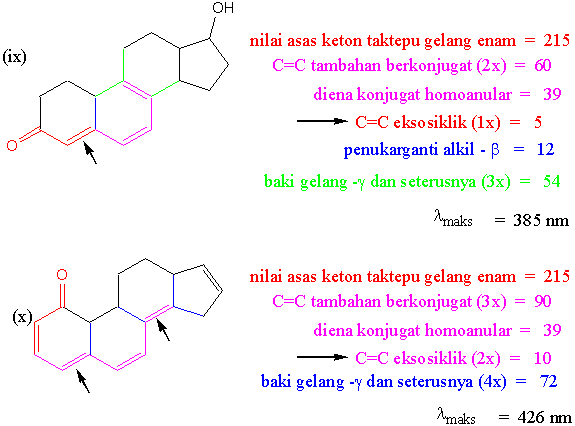
Jawapan Tugasan I
1. Orbital-orbital molekul bagi kelima-lima sebatian di bawah boleh dilukis dengan mudah. Sila lihat buku-buku kimia organik sebagai rujukan. Jawapan akan diberi kepada dua dari sebatian-sebatian ini, ia itu metil vinil keton dan benzena.
(i) 1,3-butadiena
(ii) 2,4-dimetil-1,3,5-heksatriena.
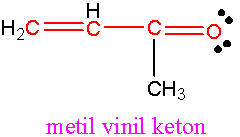
(iii) Metil vinil keton
(iv) Benzena
(v) Piridina (pyridine)
Soalannya adalah
(i) Lakar orbital-orbital molekul p ,
(ii) Tunjukkan konfigurasi elektron bagi keadaan asas elektron molekul tersebut,
(iii)Tunjukkan peralihan elektron dari HOMO ke LUMO,
(iv) Nyatakan jenis peralihan tersebut dan
(v) Dapatkan lambda maks bagi sebatian tersebut.
Strukturnya seperti di bawah menunjukkan satu sistem konjugasi antara ikatan C=C dan C=O . Perlu diingat bahawa atom oksigen mengandungi dua pasang elektron bukan pengikatan (non-bonding electrons) yang terlibat dalam konfigurasi elektron p molekul ini.
Orbital molekulnya adalah seperti di bawah. Sistem orbital pi terbit dari pertindihan orbital-orbital p dalam ketiga-tiga atom karbon dan satu atom oksigen dalam molekul tersebut. Mengikut teori orbital molekul, bilangan orbital molekul yang akan di bentuk mestilah sama dengan bilangan orbital atom (orbital p) yang terlibat dalam pembentukan tersebut. Oleh itu, 4 orbital p harus menghasilkan empat orbital molekul dengan kombinasi pertindihan orbital p yang berbeza. Hakikatnya terdapat empat cara berbeza menggambarkan pertindihan ini seperti gambarajah di bawah.
Susunan adalah mengikut aras tenaga orbital tersebut di mana pertindihan yang paling banyak mengandungi tenaga terendah dan dilukis pada aras terbawah. Ketetapan yang dibuat adalah mengenai bilangan satah nodal (nodal plane) ia itu satah yang dapat dilukis apabila berlaku pertukaran fasa (atau tanda + atau -) antara dua orbital yang berjiran. Umpamanya, dalam gambarajah di bawah, orbital molekul terbawah tidak mempunyai satah nodal, kemudian diikut dengan satu satah nodal, dua satah nodal dan akhir sekali tiga satah nodal bagi orbital molekul teratas.
Orbital bukan pengikatan dari atom oksigen pula mempunyai aras tenaga yang pertengahan. Oleh kerana di situ juga ada elektron (4 biji = dua pasang), orbital n ini juga perlu di sertaka dalam sistem elektron pi molekul tersebut. Mereka diletaskan pada aras yang sama kerana mempunyai tenaga yang sama yang dipanggil orbital degenerat (degenerate orbital). Bukan hanya dikhaskan kepada orbital n, orbital-orbital yang yang mempunyai tenaga yang sama juga dipanggil orbital degenerat. Orbital-orbital degenerat dapat ditentukan dengan mempunyai bilangan satah nodal yang sama. Konfigurasi elektron bagi keadaan asas molekul metil vinil keton ini adalah seperti di bawah di mana dua orbital pi terisisi dengan elektron di panggil orbital pengikatan (bonding orbital), dua orbital n juga terisi di panggil orbital bukan pengikatan (non-bonding orbital) dan dua orbital pi yang teratas tidak terisi yang dipanggil orbital anti-pengikatan (anti-bonding orbital).

Peralihan yang terendah sekali tenaganya adalah dari orbital terisi yang tertinggi (HOMO) ia itu orbital n (bukan pengikatan) kepada orbital takterisi terendah (LUMO). Ini dapat di lihat dalam gambaran di bawah.
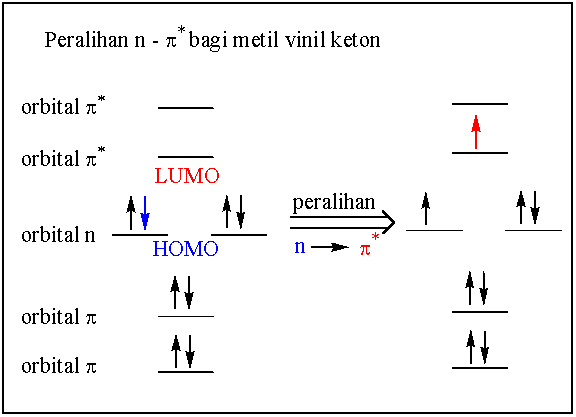
l maks bagi metil vinil keton adalah 212.5 nm dan e maks (7,000) bagi jalur K ia itu peralihan p- p* manakala bagi jalur R ia itu peralihan n – p* di atas adalah lmaks 320 nm dan e maks hanya 21 sahaja.
Orbital molekul bagi benzena yang merupakan sistem konjugat bergelang adalah berbeza sedikit dari sistem konjugasi rantai lurus. Sistem gelang menjadikan simetri molekul meningkat dan terbit beberapa orbital molekul yang degenerat (sama tenaga) disebabkan wujudnya satah nodal yang sama banyak.
Sistem pi gelang benzena terbit dari tindihan 6 orbital p dari enam atom karbon. Orbital-orbital molekul yang terbentuk mestilah juga enam seperti berikut.
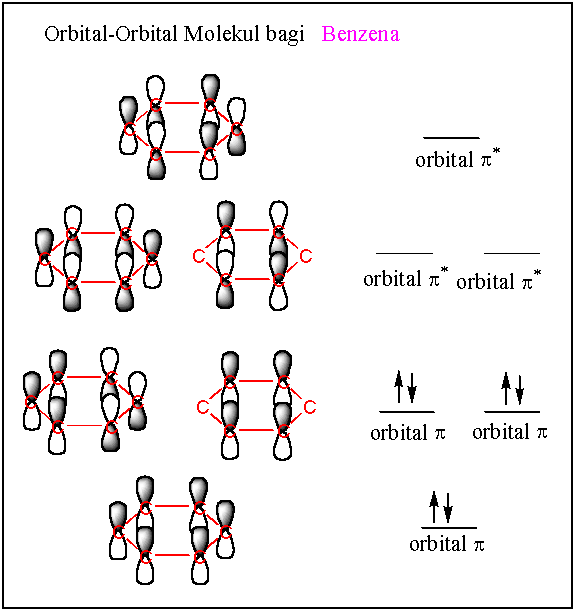
Seperti biasa peralihan elektron pertama yang boleh berlaku adalah dari HOMO ke LUMO. Ada dua orbital HOMO dan dua orbital LUMO. Oleh itu pengujaan mana-mana elektron dari HOMO ke LUMO boleh berlaku dengan tenaga yang sama.
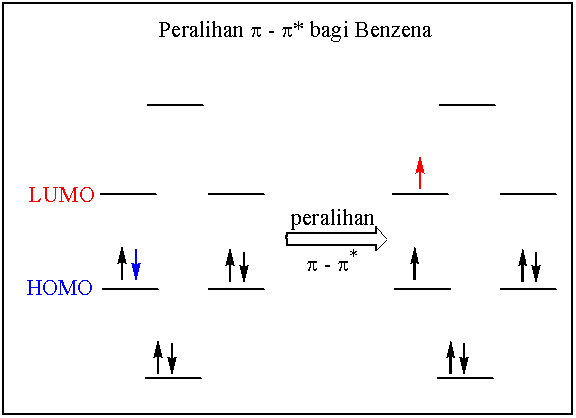
l maks bagi benzena pada 256 nm dengan e maks hanya 200 bagi jalur B (jalur benzenoid) yang terlarang disebabkan oleh simetri peralihan yang tinggi.
2. Soalan 2 adalah suatu soalan aplikasi dimana anda di minta mengira kedayaserapan molar (e maks) bagi sebatian 2,5-dimetil-2,4-heksadiena berdasarkan spektrum UV yang diberi. Ini dengan mudah boleh dikira dengan formula keserapan (A – absorbance).