J

Peperiksaan Semasa Cuti Panjang
April 2001
KTT 111/3 – Kimia Takorganik I
Jawapan Soalan 1, 2 dan 3
Dr. Farook Adam
1. (a) Formula empiris MDMA boleh ditentukan seperti jadual berikut:
|
|
C |
H |
N |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
= |
11.08 |
15.05 |
1 |
2.02 |
|
|
|
|
|
|
|
= |
11 |
15 |
1 |
2 |
|
|
|
|
|
|
|
Formula Empiris = |
C11H15NO2 |
|
|
|
(b)
|
|
C |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
= |
1 |
1.4 |
|
|
|
|
|
= |
5 |
7 |
|
|
|
|
|
Formula Empiris
= |
C5H7 |
|
|
|
|
|
|
m(C5H7) = 536.89 |
|
|
|
|
|
|
|
m(5 x 12.01+ 7 x 1.008 = 536.89 |
||
|
|
||
|
m(67.106) = 536.89 |
||
|
|
||
|
m = = 8 \Formula molekulnya = C40H56 |
||
(c) i. K2CrO4 = 2 x 39.098 x 51.996 + 4 x 15.999
= 194.188
Jisim K2CrO4 yang ditimbang 194.188 g
ii. Pelajar telah sediakan larutan yang lebih cair daripada 1.00 M
kerana isipadu akhirnya akan menjadi lebih daripada 1.00 L.
iii. (a) Timbang dengan jitu 194.188 g K2CrO4.
(b) Masukkannya ke dalam kelalang volumetrik 1.0 L yang
mengandungi 200 hingga 300 mL air.
(c) Goncang sehingga semua hablur larut.
(d) Tambah air suling ke tanda 1.00 L.
2. (a) Jadual berikut menunjukkan bilangan proton (p), elektron (e) dan nisbah proton ke elektron (p/e). Jawapan boleh diperolehi dengan membandingkan nisbah p/e.
|
|
p |
e |
p/e |
|
|
|
|
|
|
Na |
11 |
11 |
1.0 |
|
|
|
|
|
|
Mg |
12 |
12 |
1.0 |
|
|
|
|
|
|
Na+ |
11 |
10 |
1.1 |
|
|
|
|
|
|
Mg2+ |
12 |
10 |
1.2 |
|
|
|
|
|
|
O2- |
8 |
10 |
0.8 |
|
|
|
|
|
|
|
|
|
|
|
Mg2+
< Na+ <
Na < Mg
< O2- |
|||
Di antara Na dan Mg, kaedah yang digunakan ialah – lebih kekanan jadual berkala maka semakin kecil saiz atom.
(b) Jawapannya boleh diperolehi jika konfigurasi elektron bagi spesies Na, Na+ dan Na2+ di bandingkan seperti berikut:
|
Na : 1s2 2s2 2p6 3s1 |
|
|
|
Na+ : 1s2 2s2 2p6 = [Ne] sangat stabil |
|
|
|
Na2+ : 1s2 2s2 2p5 |
|
|
|
Untuk membentuk Na2+ k.e. [Ne] perlu dipecahkan yang akan |
|
memerlukan tenaga yang amat tinggi. |
|
|
|
\ T.E. kedua Na > T.E. pertama |
2. (c) Cr2+ :
[Ar] 3d4 Þ 4e tak berpasangan
![]() Fe2+
: [Ar] 3d6 Þ ↑
Fe2+
: [Ar] 3d6 Þ ↑
↑
↑ Orbital 3d diisi
mengikut hukum Afbau.
↑
↑↓
Dua spesis yang mempunyai 4 elektron
tak berpasangan ialah Cr2+ dan Fe2+.
(d)
ICl ® IO3-
+ I2 + Cl-
(i) ICl ® IO3-
+ Cl-
3H2O
+ ICl ® IO3-
+ Cl-
3H2O
+ ICl ® IO3-
+ Cl- +
6H+
(2) 3H2O +
ICl ® IO3- + Cl- + 6H+
+ 4e- ---
(A)
(ii) 2ICl ® I2 + 2Cl-
(1) 2e- +
2ICl ® I2 +
2Cl- ---(B)
![]() (B) x 2 4e- +
4ICl ® 2I2 +
4Cl- ---(C)
(B) x 2 4e- +
4ICl ® 2I2 +
4Cl- ---(C)
![]() (C) + (A) 3H2O +
ICl ® IO3- + Cl- + 6H+ + 4e-
(C) + (A) 3H2O +
ICl ® IO3- + Cl- + 6H+ + 4e-
|
3H2O +
5ICl ® IO3- +
2I2 + 5Cl- + 6H+ |
3. (a) Jadualnya
boleh dilukis seperti berikut:
|
n |
l |
ml |
ms |
|
4 |
0 |
0 |
+ ½ |
|
|
0 |
0 |
- ½ |
|
|
1 |
-1 |
+ ½ , - ½ |
|
|
|
0 |
+ ½ , - ½ |
|
|
|
1 |
+ ½ , - ½ |
|
|
2 |
-2 |
+ ½ , - ½ |
|
|
|
-1 |
+ ½ , - ½ |
|
|
|
0 |
+ ½ , - ½ |
|
|
|
+1 |
+ ½ , - ½ |
|
|
|
+2 |
+ ½ , - ½ |
|
|
3 |
-3 |
+ ½ , - ½ |
|
|
|
-2 |
+ ½ , - ½ |
|
|
|
-1 |
+ ½ , - ½ |
|
|
|
0 |
+ ½ , - ½ |
|
|
|
+1 |
+ ½ , - ½ |
|
|
|
+2 |
+ ½ , - ½ |
|
|
|
+3 |
+ ½ , - ½ |
|
|
|
|
|
Terdapat 16 elektron dengan ms = +
½
3. (b) 
n2 =
10, n1 = 4
![]()
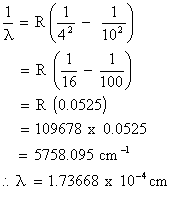
3. (c) Untuk
memecahkan 1 ikatan Cl – Cl
tenaga ![]() molekul-1
molekul-1
= 5.4485 x 10-19 J molekul-1
E
= ![]()
![]()
= ![]()
= 3.648
x 10-7 m
= 3.648
x 10-7 x 109 nm
= 364.8
nm