SANGKAR
Struktur sangkar berjulat dari sebatian-sebatian klatrat ke gugusan
logam-logam dan borana.
Molekul jenis sangkar yang ringkas sekali didapati di fosforus putih, P4.
Walaupun molekul P2 berisoelektron dengan molekul N2, dan
boleh didapati wap fosforus P2 pada suhu tinggi, P4
adalah lebih stabil pada suhu bilik. Molekul ini adalah tetrahedron atom
fosforus:

Rajah
1: Molekul P4
Struktur seperti ini memerlukan sudut ikatan 60o. Sudut antara
orbital yang terendah yang boleh didapati menggunakan hanya orbital s dan p
ialah 90o dengan menggunakan orbital p tulen. Sudut ikatan rendah
dalam P4 mesti dicapai sama
ada melalui penglibatan ciri orbital d atau penggunaan "ikatan
bengkok." Yang terdahulu memerlukan tenaga pengujaan yang tinggi dan sebab
itu tidak mungkin berlaku. Yang kemudian menyebabkan kehilangan tenaga
pengikatan sebanyak 23 kcal/mol
disebabkan keterikan. Molekul itu didestabilkan dan agak reaktif. Ia bertindak
mudah dengan oksigen untuk membentuk oksida campuran dan boleh diubah dengan
mudah kepada alotrop yang lebih stabil:
![]() P4 +
O2 P4O6, P4O10 (1)
P4 +
O2 P4O6, P4O10 (1)
![]() hυ /haba Px
(fosforus merah) (2)
hυ /haba Px
(fosforus merah) (2)
![]()
![]() tekanan/mangkin
Hg Px
(fosforus hitam) (3)
tekanan/mangkin
Hg Px
(fosforus hitam) (3)
![]()
Hablur “fosforus hitam” mempunyai struktur lapisan beralur-alur.
"Fosforus merah" mungkin
mengandungi rantai tersusun rawak. Kadar pembentukan bertambah oleh bahan bahan
tertentu seperti iodin yang akan terkandung di dalam hasil.

Rajah
2: Molekul sangkar fosforus (a) P4O6
(b) P4O10 (c) P4(NCH3)6
Kedua-dua oksida fosforus mempunyai struktur sangkar dengan simetri
tetrahedral [Rajah 2(a),(b)]. Formula
molekul adalah P4O6
dan P4O10 walaupun mereka dirujukkan sebagai
"trioksida" dan "pentoksida" berdasarkan formula empirikal
P2O3 dan P2O5.
Kedua-dua oksida adalah
anhidrida dan bertindak balas mudah dengan air untuk membentuk asid yang
sepadan:
![]() P4O6 air sejuk 4HPO(OH)2 (4)
P4O6 air sejuk 4HPO(OH)2 (4)
![]() P4O10 + 6H2O 4OP(OH)3 (5)
P4O10 + 6H2O 4OP(OH)3 (5)
Tambahan pula pada
molekul sangkar diskret yang digambarkan di atas, fosforus pentoksida juga
wujud dalam beberapa bentuk polimer.
Tindak balas fosforus triklorida dengan metilamina menghasilkan sangkar
fosforus imida [Rajah 2(c)] berisoelektron
dan berisostruktur dengan P4O6:
![]() 4PC13 +18CH3NH2 P4(NCH3)6
+12CH3NH3Cl (6)
4PC13 +18CH3NH2 P4(NCH3)6
+12CH3NH3Cl (6)
Kimia
fosforus-sulfur adalah agak lebih rumit daripada kimia fosforus‑oksigen. Hanya satu daripada fosforus sulfida, P4S10,
adalah berisoelektron dan berisostruktur dengan fosforus oksida. P4S10
boleh disediakan dengan menjalankan tindak balas dengan menggunakan kuantiti
stoikiometrik fosforus dan sulfur:
![]() 4P4 + 5S8 4P4S10
(7)
4P4 + 5S8 4P4S10
(7)
Dengan mencampurkan
fosforus dan sulfur dalam kuantiti stoikiometrik yang sesuai, dua sulfida yang lain mungkin diperolehi:
![]() 8P4 + 3S8 8P4S3 (8)
8P4 + 3S8 8P4S3 (8)
![]() 8P4 + 7S8 8P4S7
(9)
8P4 + 7S8 8P4S7
(9)
Fosforus sulfida keempat boleh disediakan dengan pengoksidaan perlahan P4S3
dengan sulfur:
meresap
![]() 4P4S3 + S8
cahaya,CS2 4P4S5 (10)
4P4S3 + S8
cahaya,CS2 4P4S5 (10)
Struktur semua
sulfida adalah diketahui (Rajah 3). Mereka semuanya diterbitkan daripada
tetrahedron atom fosforus dengan atom sulfur
titian sepanjang tepi yang berlainan. Semua kecuali P4S10 mengekalkan satu atau lebih
ikatan P-P.
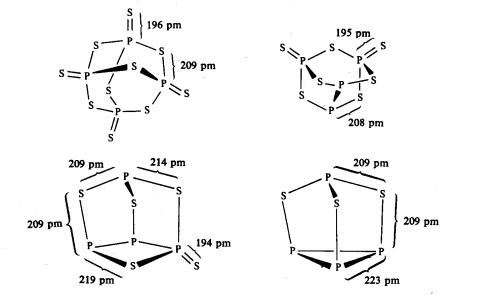
Rajah 3:
Struktur molekul beberapa fosforus sulfida
Kongener fosforus
yang lebih berat menyerupainya dalam kecenderungan membentuk sangkar. Kedua-dua
arsenik dan antimoni membentuk molekul
tetramerik tak stabil yang bertindak balas dengan mudah membentuk
struktur polymer. Molekul sangkar adalah dikenali sebagai As4O6
dan Sb4O6 dan juga bentuk polymer. Tambahan pula beberapa
jenis sulfida diketahui wujud sebagai sangkar (Rajah 4).
