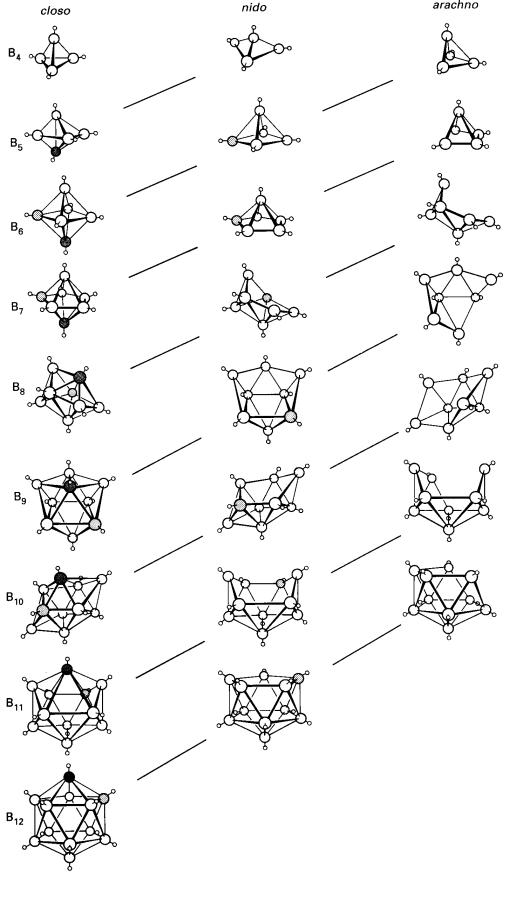
KUMPULAN BORON [KUMPULAN 13]
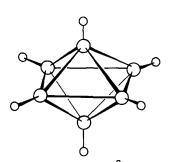
Kumpulan boron menunjukkan pelbagai struktur. Boron sendiri wujud dalam
beberapa polimorf yang keras dan refraktori. Tiga fasa pepejal di mana struktur
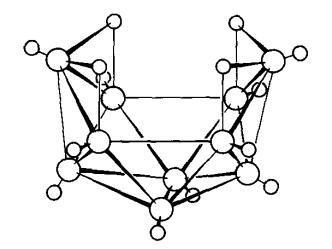
hablur didapati mengandungi ikosahedral (20-permukaan) unit B12
sebagai blok pembinaan (Rajah 1) unit ikosahedral adalah satu motif berlaku
dalam kimia boron. Semua kongener boron adalah logam.
Rajah 1. Pandangan ikosahedra B12
dalam boron α-rombohedra

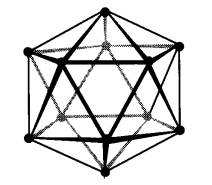
(a) sepanjang paksi lipatan-tiga (b)
tegak kepada paksi lipatan-tiga
Pengikatan dan struktur borana
yang lebih tinggi dan borohidrida
Dalam bahagian ini kita akan
huraikan struktur dan sifat bagai sangkar borana dan borohidrida, termasuk siri
Alfred Stock BnHn+4 dan BnHn+6 dan
juga [BnHn]2- polihedra tertutup. Borana dan
borohidrida wujud dalam pelbagai bentuk, ada yang merupakan sarang dan yang
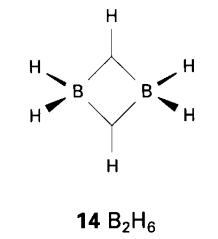
lain merupakan rama-rama (Lihat Rajah 2). mereka adalah kekurangan elektron
iaitu tidak dapat dihuraikan dengan struktur elektron Lewis.
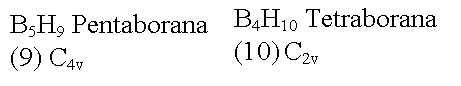
B6H10
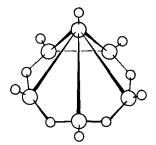
Heksaborana (10) Cs B5H11
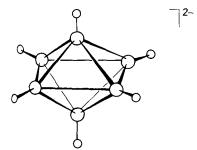
Pentaborana (11) Cs Kloso-[B6H6]2-
Oh
Kloso-[B12H12]2-
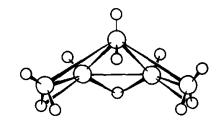
Ih B10H14
Dekaborana (14) C2v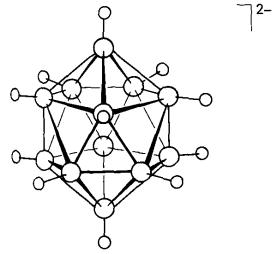
Penerangan moden bagi pengikatan dalam borana dan borohidrida diperolehi
daripada kerja Christopher Longuet-Hinggins, sebagai mahasiswa Oxford, telah menerbitkan kertas seminar di mana beliau
memperkenalkan konsep ikatan 3c,2e (3 pusat 2 elektron). Kemudian beliau
mendapat pengolahan orbital molekul taksetempat sepenuh bagi boron polihedra
dan meramalkan kestabilan ion ikosahedral [B12H12]2-,
yang disahkan pada akhirnya. William Lipscomb dan penuntutnya di USA
menggunakan belauan sinar-X hablur tunggal untuk menentukan struktur borana dan
borohidrida, dan mengembangkan konsep pengikatan berbilang pusat kepada spesis
yang lebih kompleks.
Dari segi orbital molekul taksetempat sepenuh sebatian gugus boron
mengandungi elektron yang menyumbang kepada kestabilan keseluruhan molekul.
Bagaimanapun, untuk menentukan kumpulan tiga atom dan menganggap mereka
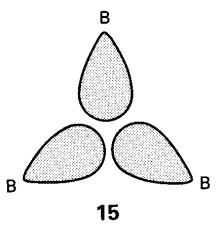
diikatkan sekali dengan versi ikatan 3c,2e yang wujud dalam borana sendiri(14). Dalam borana yang lebih rumit,
tiga pusat ikatan 3c,2e mungkin ikatan titian B-H-B, tetapi mungkin juga ikatan
di mana tiga atom B berada pada penjuru segitiga sisi sama dengan orbital
hibrid sp3 pertindihan pada pusatnya(15).
Satu korelasi antara bilangan elektron, formula dan bentuk molekul
diwujudkan oleh ahli kimia Kenneth Wade pada 1970. Peraturan Wade digunakan
bagi satu kelas polihedra dinamakan deltahedra (kerana terdiri daripada
permukaan segitiga yang menyerupai simbol delta, D). Bagi borana dan borohidrida, mereka membolehkan
kita meramalkan bentuk umum molekul atau anion daripada formula. Bagaimanapun,
oleh kerana peraturan Wade juga menyebutan bilangan elektron yang menyumbang
kepada pengikatan rangka spesies, kita dapat memanjangkan peraturan itu kepada
bahan lain di mana atom-atomnya lain daripada boron, contohnya karborana dan
gugus blok-p yang lain.
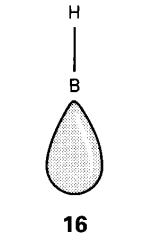
Bagi borana dan borohidrida,
blok pembinaan dari mana deltahedron
dibentuk dianggap sebagai satu kumpulan BH (16). Elektron pada ikatan B-H diabaikan dalam prosedur pembilangan,
tetapi yang lain dikira sama ada mereka memegang rangkanya atau tidak. Rangka maksudnya rangka gugus dengan
setiap kumpulan BH dikira sebagai satu unit. Jika satu atom B membawa dua atom
H, hanya satu ikatan B-H dianggap sebagai satu unit. Contohnya, bagi B5H11,
satu daripada atom B mempunyai dua atom H hujung, tetapi satu entiti BH
dianggap sebagai satu unit, pasangan elektron yang lain dianggap sebagai
sebahagian rangka dan sebab itu dikelaskan sebagai elektron rangka. Satu kumpulan BH menyumbang dua elektron kepada
jumlah elektron rangka.
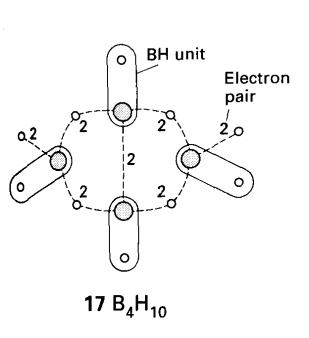
Contoh: Hitung bilangan elektron rangka
dalam B4H10.
Jawapan. Empat unit BH menyumbang 4 x 2 = 8 elektron dan
enam atom H tambahan menyumbang lagi 6 elektron, memberi semuanya 14. Akhirnya
tujuh pasangan menyumbang tujuh ikatan (17)
: dua digunakan untuk ikatan B-H hujung tambahan, empat digunakan untuk empat
titian B-H-B, dan satu digunakan untuk ikatan B-B pertengahan.
Jadual 1: Pengkelasan dan penghitungan elektron boron hidrida
Jenis Formula Pasangan Contoh
elektron rangka
Kloso [BnHn]2- n + I [B5H5
]2- - [B12H12]2-
Nido
BnHn+4 n + 2 B2H6, B5H9, B6H9
Arachno BnHn+6 n + 3 B4H10, B6H11
Mengikut peraturan Wade
(Jadual 1), spesies dengan formula [BnHn]2-
didapati mempunyai struktur kloso
(sarang dalam Yunani) dengan satu atom B pada setiap penjuru deltahedron
tertutup dan tiada ikatan B-H-B . struktur seperti ini mempunyai n+1 pasangan
elektron rangka. Siri anion ini dikenali bagi n=5 ke 12, dan contohnya termasuk
ion bipiramid trigonal [B5H5]2-, ion oktaheral
[B6H6]2- dan ion ikosahedral [B12H12]2-.
Kloso-borohidrida dan analog karborana adalah stabil secara termal dan takreaktif.
Gugus boron berformula BnHn+4
mempunyai struktur nido (sarang dalam
Latin). Mereka diterbitkan daripada kloso-borana
yang telah hilang satu mercu tetapi mungkin mempunyai ikatan
B-H-B dan juga ikatan B-B. Sebatian dalam siri ini mengandungi n+2 pasangan
elektron rangka. Contohnya B5H9.
Umumnya kestabilan termal
nido-borana
adalah perantaraan kloso- dan arachno-borana.
Contoh:
Dengan menggunakan peraturan Wade,
simpulkan struktur [B5H5]2- daripada
formulanya dan daripada penghitungan elektron.
Jawapan. Perhatikan bahawa sebatian [B5H5]2-
dimiliki satu kelas borohidrida yang mempunyai formula [BnHn]2-,
yang berciri spesies kloso. Secara alternatif, kita
boleh menghitung pasangan elektron rangka dan mendeduksikan jenis struktur.
Anggapkan satu ikatan B-H per atom B, terdapat lima unit BH; jadi sepuluh
elektron rangka tambah dua daripada keseluruhan cas -2: 5 x 2 + 2 = 12, atau
2(n+1) dengan n=5. Nombor ini berciri gugus kloso.
Polihedron tertutup mesti mengandungi permukaan segitiga dan lima mercu; jadi
satu struktur trigonal bipiramid diperlihatkan.
Gugus yang berformula BnHn+6 mempunyai struktur arachno (labah-labah dalam Yunani) dan adalah polihedra kloso-borana kurang dua mercu. Arachno-borana mempunyai n+3 pasangan
elektron rangka. Contoh arachno-borana
ialah pentaborana, B5H11. Pentaborana adalah tidak stabil
secara termal pada suhu bilik dan sangat reaktif.
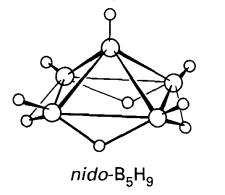
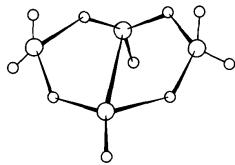
Satu struktur yang berguna korelasi antara spesi kloso-, nido- dan arachno- berdasarkan
pemerhatian bahawa gugus dengan bilangan sama dengan elektron rangka adalah
berhubungan dengan pengeluaran kumpulan BH berlebihan dan penambahan bilangan
elektron dan atom H yang sesuai. Rajah 3 menunjukkan pengeluaran satu unit BH
dan dua elektron dan penambahan empat atom H menukarkan anion oktahedral kloso-[B6H6]2-
kepada piramid segiempat sama borana nido-B5H9.
Proses yang serupa menukarkan nido-B5H9 kepada
struktur rama-rama borana arachno-B4H10.
Setiap tiga borana mempunyai 14 elektron rangka, tetapi bilangan elektron
rangka per atom B bertambah, dan struktur menjadi lebih terbuka (Rajah 4).
Rajah 3: Korelasi struktur antara struktur oktahedral B6, nido-B5 piramid persegi dan arachno-B4 rama-rama
kloso- [B6H6]2-
![]() -BH
-BH
+4H
-2e
-BH
![]()
+2H
arachno-B4H10
Rajah 4: Beberapa borana berbeza
Peraturan Wade digunakan dengan menghitungkan orbital molekul. Dengan
mempertimbangkan peraturan n+1, kita akan menunjukkan bahawa [B6H6]2-mempunyai
tenaga yang rendah jika ia mempunyai struktur kloso oktahedral, seperti yang diramalkan oleh peraturan.
Ikatan B-H menggunakan satu elektron dan satu orbital atom B, meninggalkan
tiga orbital dan dua elektron untuk pengikatan rangka. Satu daripada orbital
itu, yang dipanggil orbital jejari, boleh dipertimbangkan sebagai hibrid sp
boron mengarah ke dalaman serpihan (lihat 16).
Dua orbital p boron yang lain, iaitu orbital tangen, adalah tegak kepada
orbital jejari (18). Bentuk 18 kombinasi linear disuai simetri
akan diperolehi daripada 18 orbital dalam gugus oktahedral B6H6.
Ciri orbital pengikatan ditunjukkan pada Rajah 5.
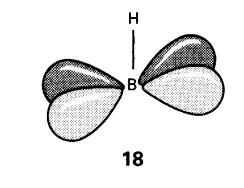
Rajah 5: Orbital molekul pengikatan
jejari dan tangen bagi [B6H6]2-. Tenaga
relatif a1g< t1u< t2g
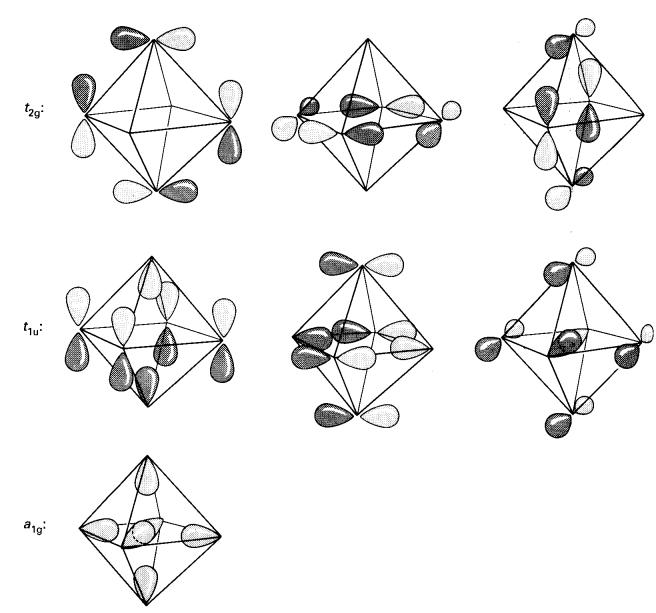
Orbital yang bertenaga paling
rendah adalah simetri sepenuhnya (a1g) dan timbul daripada sumbangan
dalam-fasa dari semua orbital jejari. Perkiraan menunjukkan orbital berikut
yang lebih tinggi daripada a1g adalah 3 orbital degenerate t1u
, setiap daripadanya adalah kombinasi empat orbital tangen dan dua orbital
jejari. Di
atas tiga orbital degenerat terletak lagi tiga orbital t2g,
memberikan tujuh orbital pengikatan semuanya. Jadi terdapat tujuh orbital
pengikatan desetempat pada rangka, dan mereka dipisahkan dengan jauh daripada
sebelas orbital
anti-pengikatan yang lain
(Rajah 6).
Rajah 6: Gambarajah skema
paras tenaga orbital molekul rangka
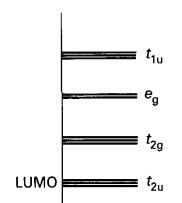 atom-B
atom-B
![]()
Tenaga
![]()
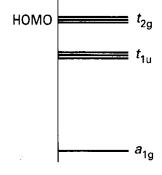
Terdapat tujuh pasangan elektron untuk ditempatkan, sepasang daripada
setiap enam atom B dan sepasang daripada cas -2 keseluruhan. Kesemua tujuh
pasangan dapat masuk dan mengisi tujuh orbital rangka pengikatan, dan oleh itu
mewujudkan satu struktur stabil, mengikut peraturan n+1. Perhatikan bahawa
molekul oktahedral B6H6 neutral mempunyai elektron yang
kurang untuk memenuhi orbital pengikatan t2g dan oleh demikian
dijangkakan tidak stabil.
Sintesis borana lebih tinggi dan
borohidrida
Pirolisis terkawal B2H6 dalam fasa gas membawa kepada sintesis kebanyakan borana tinggi dan
borohidrida, termasuk B4H10, B5H9
dan B10H14. Langkah pertama dalam mekanisma cadangan
adalah penceraian B2H6 dan kondensasi hasil BH3
dengan serpihan borana. Contohnya, mekanisma pembentukan tetraborana(10)
melalui pirolisis diborana diperlihatkan sebagai:
![]() B2H6(g) 2 BH3(g)
B2H6(g) 2 BH3(g)
![]() B2H6(g) +
BH3(g) B3H7(g) +
H2(g)
B2H6(g) +
BH3(g) B3H7(g) +
H2(g)
![]() BH3(g) +
B3H7(g) B4H10(g)
BH3(g) +
B3H7(g) B4H10(g)
Sintesis tetraborana, B4H10, adalah susuh kerana ia
adalah sangat tak stabil secara termal, sejajar dengan ketidakstabilan siri BnHn+6
(arachno). Untuk menambahkan
peratusan hasil tindak balas, hasil yang keluar dari reaktor panas dilindap
dengan serta merta pada permukaan sejuk. Sintesis pirolitik untuk membentuk
spesies bagi siri BnHn+4 (nido) yang lebih stabil memberikan peratusan hasil yang lebih
tinggi, tanpa memerlukan lindapan cepat. Oleh
demikian, B5H9 dan B10H14 dapat
disediakan secara mudah dengan tindak balas pirolisis.
Tindak balas ciri borana dan borohidrida
Tindak balas ciri gugus boron adalah pembelahan bes Lewis, pengdeprotonan,
pembesaran gugus dan penyesaran proton oleh elektrofil.
1. Tindak balas pembelahan bes Lewis
Contoh : Diborana
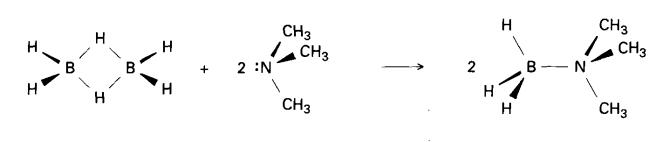
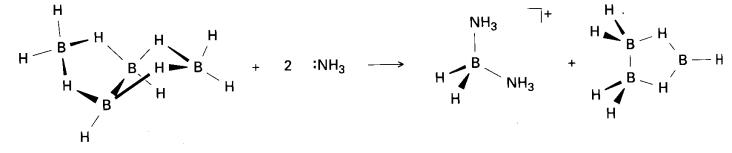
Dengan borana yang besar B4H10,
pembelahan boleh memutuskan beberapa ikatan B-H-B menyebabkan penyerpihan
separa gugus:
2. Pengdeprotonan
![]() B10H14 + N(CH3)3 [HN(CH3)3]+[
B10H13]-
B10H14 + N(CH3)3 [HN(CH3)3]+[
B10H13]-
Struktur anion hasil menunjukkan pengdeprotonan berlaku pada titian B-H-B 3c,2e, supaya bilangan elektron pada gugus boron tak berubah. Pengdeprotonan ikatan B-H-B 3c,2e untuk mengasilkan ikatan B-B 2c,2e berlaku tanpa gangguan kepada pengikatan:.
![]()
![]() B B Ø-
B B Ø-
![]()
![]()
![]() B B + H+
B B + H+
H
Keasidan BrÆnsted boron hidrida bertambah dengan saiz:
B4H10 < B5H9 < B10H14
Trend ini berkorelasi dengan pendesetempatan cas yang lebih dalam gugus yang lebih besar, dalam cara yang sama di mana keasidan fenol yang lebih besar daripada metanol dapat dijelaskan dengan konsep pendesetempatan. Pengubahan dalam keasidan ditunjukkan dengan pemerhatian bahawa, bes lemah trimetilamina menyahprotonkan dekaborana (14), tetapi bes yang lebih kuat metillitium diperlukan untuk menyahprotonkan B5H9 :
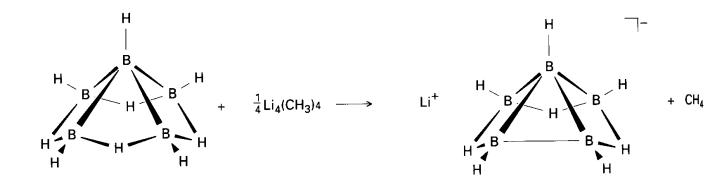
Ciri hidridik terdapat pada borohidrida beranion kecil. BH4- menyerah satu ion hidrida
dengan mudah dalam tindak balas:
![]() BH4- +
H+
½ B2H6 +
H2
BH4- +
H+
½ B2H6 +
H2
Ion [B10H10]2- wujud tanpa menyerah ion hidrida walaupun di dalam larutan asid yang kuat. Garam hidronium (H3O)2B10H10 dapat juga dihablurkan.
3. Tindak balas pembinaan gugus antara borana dan borohidrida memberikan satu jalan
yang senang ke ion borohidrida yang lebih tinggi:
polieter, 85oC
![]() 5K[B9H14] + 2 B5H9 5K[B11H14]
+ 9H2
5K[B9H14] + 2 B5H9 5K[B11H14]
+ 9H2
Tindak balas serupa digunakan
untuk membina borohidrida yang lain, seperti [B10H10]2-.
Tindak balas ini telah digunakan untuk mensintesis julat besar borohidrida
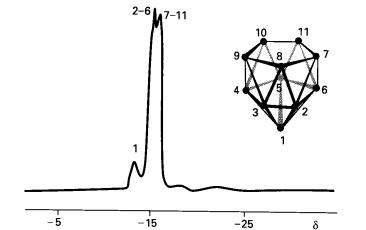
polinuklear. Spektroskopi NMR Boron-11 (Rajah 7) menyatakan bahawa rangka boron
dalam [B11H14]- mengandungi ikosahedron yang
kehilangan satu mercu.
Rajah 7: Spektroskopi NMR Boron-11
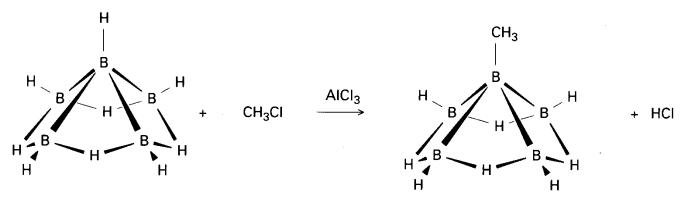
4. Penyesaran elektrofilik H+ memberikan
satu jalan ke spesies teralkil dan terhalogen. Seperti tindak balas
Friedel-Crafts, penyesaran elektrofilik H dimangkinkan oleh asid Lewis, seperti
aluminium klorida, dan gantian berlaku secara umum pada bahagian tertutup gugus
boron.
Metaloborana
Banyak metaloborana, atau
gugus borana terkandung logam, telah dicirikan. Pada kes tertentu logam diikat
kepada ion borohidrida melalui titian hidrogen. Sebahagian besar metaloborana
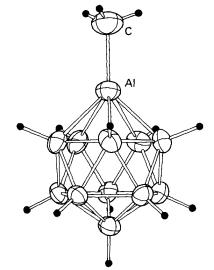
mempunyai ikatan logam-boron yang terus. Contoh borana logam kumpulan utama
dengan rangka ikosahedral ditunjukkan pada Rajah 8. Ia disediakan dengan saling
tindakan dengan hidrogen protik dalam Na2[B11H13]
dengan trimetilaluminium:
![]() 2[B11H13]2-+Al2(CH3)6 Δ 2[B11H11AlCH3]2-
+ 4CH4
2[B11H13]2-+Al2(CH3)6 Δ 2[B11H11AlCH3]2-
+ 4CH4
Rajah 8 Struktur kloso-[B11H11AlCH3]2-
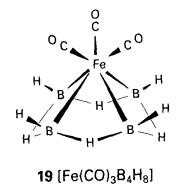
Apabila B5H9 dipanaskan dengan Fe(CO)5, analog
berlogam pentaborana dibentukkan (19).
Contoh: Cadangkan satu struktur bagi hasil tindak
balas B10H14 dengan LiBH4
dalam polieter
refluks, CH3OC2H4OCH3.
Jawapan.
Borana berasid B10H14,
dengan anion BH4- di bawah tindak balas hebat.
![]() B10H14 + Li[BH4] Eter Li[B10H13] + R2OBH3 + H2
B10H14 + Li[BH4] Eter Li[B10H13] + R2OBH3 + H2
Kondensasi kompleks BH3
neutral dengan B10H13- menghasilkan
borohidrida yang lebih besar.
![]() Li[B10H13] + R2OBH3 Li[B11H14] + H2
+ R2O
Li[B10H13] + R2OBH3 Li[B11H14] + H2
+ R2O
Dengan kehadiran Li[BH4] yang berlebihan, pembinaan gugus
berterusan untuk memberi anion ikosahedral B12H122-
yang sangat stabil:
![]() Li[B11H14] +Li[BH4] Li2[B12H12] + H2
Li[B11H14] +Li[BH4] Li2[B12H12] + H2
(nido)
(kloso)
Karborana
Karborana adalah berhubung rapat dengan
borana dan borohidrida polihedral, satu keluarga besar gugus yang mengandungi
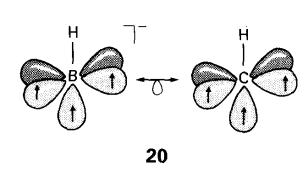
kedua-dua atom B dan C. Dengan peraturan penghitungan elektron Wade, BH-adalah
berisoelektron dengan CH (20), dan
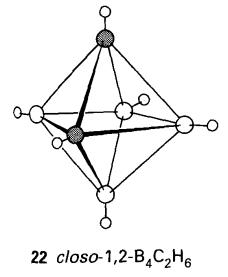
dijangka borohidrida polyhedral dan karborana adalah saling berhubungan. Sebab
itu, analog [B6H6]2- (21) adalah karborana neutral B4C2H6
(22).
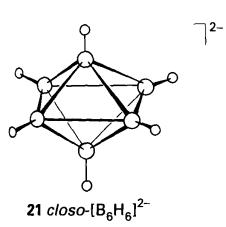
Penukaran dekarborana (14) kepada
kloso-1,2- B10C2H12 (23).
Tindak balas pertama dalam penyediaan adalah
penyesaran molekul H2 daripada dekarborana oleh tioeter:
![]() nido-B10H14
+2SEt2 arachno-B10H12(SEt2)2
+H2
nido-B10H14
+2SEt2 arachno-B10H12(SEt2)2
+H2
Dalam tindak balas ini,
molekul nido-B10H14
kehilangan molekul H2 dua-elektron dan memperolehi dua penderma
dua-elektron, SEt2; jadi keuntungan bersih dua-elektron memberi
hasil arachno. Hasil ini seterusnya boleh
ditukar kepada spesi kloso dengan
tindak balas
![]() arachno-B10H12(SEt2)2
+C2H2 kloso-B10C2H12+2SEt2
+ H2
arachno-B10H12(SEt2)2
+C2H2 kloso-B10C2H12+2SEt2
+ H2
Penghitungan elektron dalam tindak
balas kedua adalah seperti berikut:
Bahan permulaan arachno
menguntungkan dua-elektron C2H2 tetapi menghilang enam
elektron dalam dua Et2S dan satu molekul H2, bagi
kehilangan empat-elektron bersih oleh gugus. Hasil kloso mengandungi atom C dalam kedudukan sebelah (1,2) (23) mencerminkan punca dari asetilena.
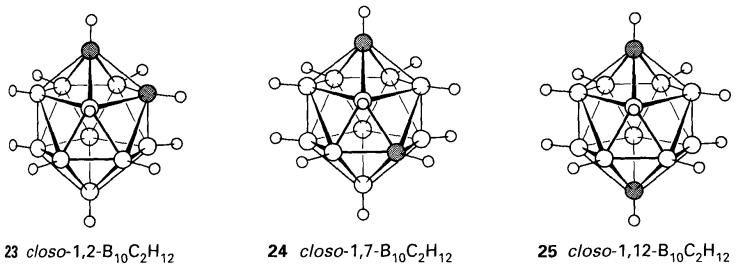
Karborana kloso wujud dalam udara dan
dapat dipanaskan tanpa penguraian. Dalam atmosfera lengai pada 500oC
ia mengalami keisomeran menjadi 1,7-B10C2H12 (24) yang seterusnya berubah pada 700oC
kepada isomer 1,12- B10C2H12 (25).
Atom H yang terlekat kepada karbon
dalam kloso- B10C2H12
adalah berasid sederhana dalam gugus, jadi sebatian itu mudah bertindak balas
dengan butilitium:
![]() B10C2H12
+ 2LiC4H9
B10C2H10Li2 +
2C4H10
B10C2H12
+ 2LiC4H9
B10C2H10Li2 +
2C4H10
Dilitiokarborana adalah nukleofil baik dan mengalami banyak tindak balas
ciri reagen organolitium. Sebab itu, satu julat besar terbitan karborana dapat
disintesis. Contohnya, tindak balas dengan CO2 memberikan asid
dikarbosilik karborana:
(1)bertindak,(2)2H20
![]() B10C2H10Li2 + 2CO2 B10C2H10(COOH)2
B10C2H10Li2 + 2CO2 B10C2H10(COOH)2
Bagitunya, I2 menuju ke diiodokarborana dan tindak balas dengan
NOCl menghasilkan B10C2H10(NO)2.
Walaupun 1,2-B10C2H12 adalah sangat
stabil, gugus itu boleh diserpihkan dalam bes kuat, dan dinyahproton dengan NaH
untuk menghasilkan nido-[B9C2H11]2-:
![]() B10C2H12
+ OEt- + 2EtOH [B9C2H12]-
+ B(OEt)3 + H2
B10C2H12
+ OEt- + 2EtOH [B9C2H12]-
+ B(OEt)3 + H2
![]() Na[B9C2H12] + NaH Na2[B9C2H11] + H2
Na[B9C2H12] + NaH Na2[B9C2H11] + H2
Kepentingan tindak balas ini
ialah nido-[B9C2H11]2-
adalah satu ligan yang baik. Ianya mimik ligan isolobal siklopentadiena (C5H5-;
Rajah 9(b)) yang digunakan secara luas dalam kimia organologam:
![]() 2Na2[B9C2H11] + FeCl2 THF
2NaCl + Na2[Fe(B9C2H11)2]
2Na2[B9C2H11] + FeCl2 THF
2NaCl + Na2[Fe(B9C2H11)2]
![]() 2Na[C5H5] +
FeCl2 THF 2NaCl
+ Fe(C5H5)2
2Na[C5H5] +
FeCl2 THF 2NaCl
+ Fe(C5H5)2
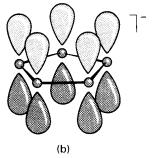
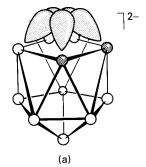
Rajah 9
Hubungan isolobal antara (a) [B9C2H11]2-
dan (b) [C5H5]-
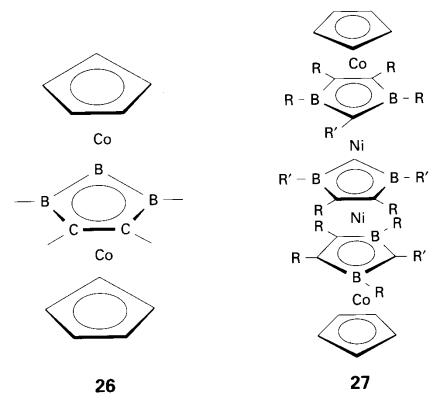
Satu sifat yang diperhatikan dalam kes pembentukan sebatian sandwic
multi-lapis mengandungi ligan karborana (26
dan 27). Ligan [B3C2H5]4-
yang sangat negatif mempunyai kecenderungan lebih besar untuk membentuk
sebatian sandwic berlapis dibandingkan dengan ligan C5H5-
yang kurang negatif dan merupakan penderma lemah.