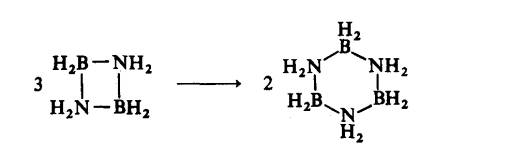
Gelang
Borazina
Sistem gelang yang paling
penting dalam kimia organik adalah gelang benzena, sama ada sebagai entiti
berasingan atau dalam hidrokarbon polinuklear seperti naftalena, antrasena, dan
fenantrena. Kimia takorganik mempunyai sekurang-kurangnya dua analog benzena:
borazina, B3N3H6, dan sebatian trimerik
fosfazina, P3N3X6.
Borazina telah diketahui sejak kerja rintis Alfred Stock pada awal abad
ini.Kerja Stock adalah penting dalam dua aspek: Beliau yang orang pertama
menyelidik sebatian seperti borana, silana, dan sebatian bukan-logam yang
serupa; beliau telah menyempurnakan teknik saluran vakum untuk mengendalikan
sebatian sensitif terhadap udara dan kelembapan. Stock telah mensintesis borazina dengan memanaskan aduk diborana dan
ammonia:
![]()
Sintesis yang lebih cekap:
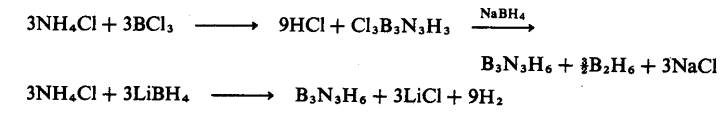
Borazina tertukarganti-N atau
-B mungkin disediakan dengan gantian pada bahan permulaan sebelum sintesis
gelang:
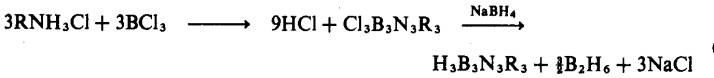
atau gantian selepas pembentukan gelang:
![]()
Borazina adalah
berisoelektron dengan benzena (Rajah 1). Sifat fizikal borazina adalah
beranalog dengan benzena. Keserupaan sifat fizikal terbitan gantian-alkil
adalah lebih istimewa. Nisbah takat didih mutlak borazina gantian kepada
terbitan benzena gantian yang
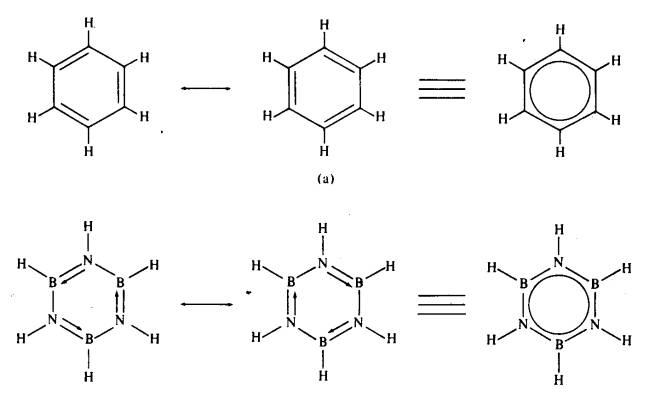
(b)
Rajah 1 Struktur elektron (a)
benzena (b) borazina
serupa ialah 0.93 ± 0.01 dan
oleh itu borazina disebut sebagai benzena takorganik. Walau demikian sifat
kimia borazina dan benzena adalah berbeza. Kedua-dua sebatian mempunyai awan
pi aromatik dengan ketumpatan elektron yang didesetempatkan di seluruh atom
gelang. Disebabkan perbezaan dalam keelektronegatifan antara boron dan
nitrogen, awan pi dalam borazina adalah "gumpal" dengan lebih banyak
ketumpatan elektron pada nitrogen
daripada boron. Pensetempatan separa melemahkan pengikatan pi dalam gelang.
Tambahan pula, nitrogen mengekalkan sebahagian kebesan dan boron sebahagian
keasidan.
Spesies berkutub seperti HC1 dapat menyerang
" ikatan dubel " antara nitrogen dan boron. Perbezaan keelektronegatifan boron dan
nitrogen berkecenderungan menstabilkan pengikatan kepada boron dengan bahan gantian elektronegatif dan kepada nitrogen dengan bahan gantian elektropositif. Oleh itu,
berlainan daripada benzena, borazina mengalami tindak balas penambahan dengan
mudah:
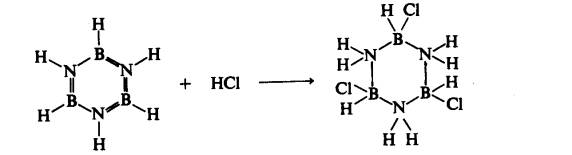
(6)
![]()
![]() Benzena
+ HCl tiada tindak balas
Benzena
+ HCl tiada tindak balas
Kecenderungan mengalami
tindak balas penambahan dan penggantian aromatik adalah berbeza bagi tindak
balas kedua-dua sebatian terhadap bromin:
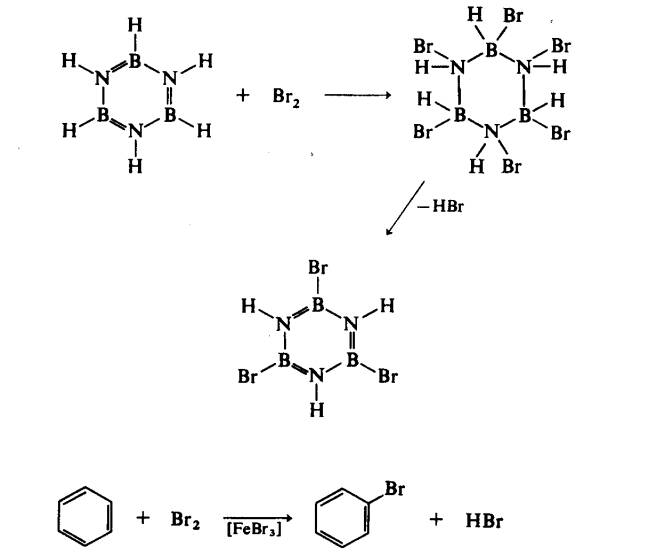
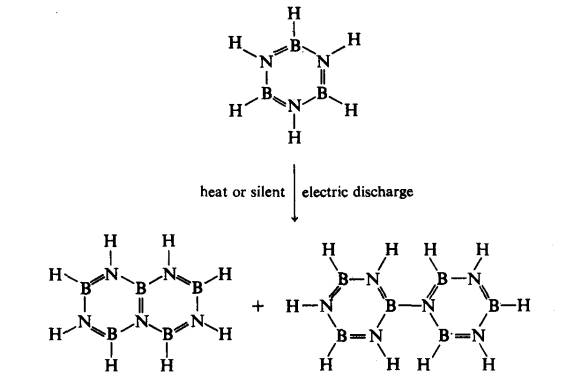
Borazina beranalog naftalena dan hidrokarbon berkaitan telah disediakan dengan pirolisis borazina atau melalui satu discas elektrik senyap:
Gelang empat-ahli, R2B2N2R2',
dan gelang lapan-ahli, R4B4N4R4',
juga diketahui tetapi kerja penyelidikan atas sebatian tersebut masih kurang
jika dibandingkan dengan borazina.
Benzena boleh dihidrogenkan untuk
menghasilkan sebatian sikloheksana tepu. Penghidrogenan borazina menghasilkan
bahan polimerik yang berkomposisi tidak tentu.
Terbitan sikloborazana tepu, B3N3H12,
terbentuk dengan mudah dengan menambahkan kepada borazina tetapi teknik
istimewa adalah diperlukan untuk menyediakan sebatian induk. Ia disediakan pada
kali pertama dengan penurunan terbitan kloro :
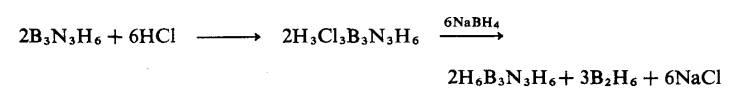
Satu siri lengkap
sikloborazana boleh disediakan dengan pengolahan aduk ammonia dan diborana
dengan satu bes yang kuat:
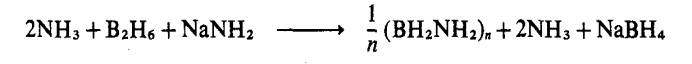
Hasil utama tindak balas
tersebut merupakan siklopentaborazana (n = 5), satu pepejal mikrohablur yang
stabil. Ianya dihidrolisiskan hanya oleh air mendidih dengan perlahan dan
hidrolisis penuh adalah berkesan hanya dengan larutan asid pada 160 oC
melalui satu tempoh berlarutan.
Siklodiborazana, H4B2N2H4,
juga boleh diasingkan dalam kuantiti kecil dalam tindak balas yang sama seperti
di atas atau dengan pirolisis siklopentaborazana. Ianya berubah secara spontan
kepada siklotriborazana
(" borazana ") bila dibiarkan pada suhu bilik:
Berisoelektron dengan borazina ialah boroksina, H3B3O3.
Ia dihasilkan dengan pengoksidaan meletup B2H6 atau B5H9.
Struktur telah ditentukan dan didapati satah sempurna. Boroksina adalah kurang
stabil (dan dianggap mempunyai pendesetempatan pi yang kurang) daripada
borazina, mengurai pada suhu bilik kepada diborana dan boron oksida.
Sebatian Fosfonitrilik
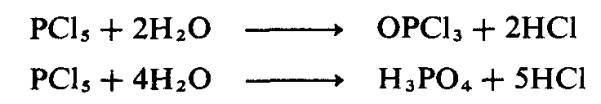
Kereaktifan fosforus pentaklorida terhadap reagen berbes seperti air atau
ammonia telah diperhatikan pada awal lagi. Tindak balas dengan air adalah jelas
bagi stoikiometri tertentu:
Bagi ammonia, sebatian HN=PCl3
dan HN=P(NH2)3 dicadangkan sebagai hasil tindak balas.
Akan tetapi pempolimeran perlahan berlaku dengan kehilangan ammonia untuk
menghasilkan “fosfam”, satu pepejal berformula (PN2H)x,
sebagai hasil pengdeammonatan.
Jika ammonia bebas diganti
dengan asid konjugat yang kurang reaktif, tindak balas berlaku pada kadar
sederhana dan keputusannya adalah lebih bermakna:
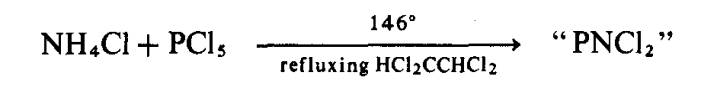
PNCl2 dipanggil
fosfonitrilik klorida atau fosfonitril, CI2PºN disebabkan mirip kepada sebatian nitril organik R-CºN . Hasil adalah berpolimerik dengan formula am (NPCl2)n.
Hasil utama dan paling mudah diasingkan ialah trimer, n = 3. Walaupun kuantiti kecil tetramer dan oligomer lain sehingga n = 8
telah dicirikan, polimer yang lebih tinggi diketahui wujud. Analog sebatian
bromo boleh disediakan dengan cara yang sama kecuali bromin mesti ditambahkan
untuk menindas penguraian fosforus pentabromida:
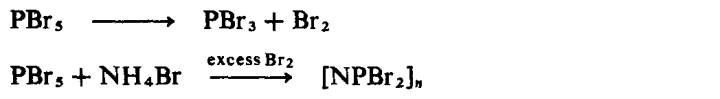
Analog fluorida mesti disediakan dengan cara
tak langsung dengan penfluorinan sebatian klorida:
Iodidanaya tidak diketahui.
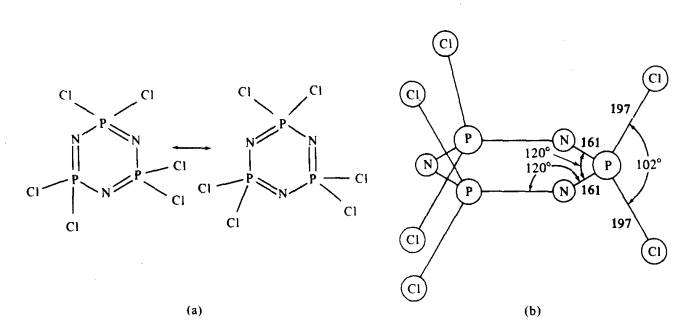
Rajah 2 Struktur trimer fosfonitrilik
klorida, P3N3Cl6: (a) struktur
resonans; (b) struktur molekul yang
ditentukan oleh pembelauan sinar-X
Trimer mengandungi gelang satah
enam-anggota (Rajah 2). Sudut ikatan adalah konsisten dengan penghibridan
sp2 nitrogen dan penghibridan hampir sp3 fosforus.
Seperti yang ditunjukkan dalam Rajah 2, struktur resonans dapat dilukis
beranalog kepada benzena menunjukkan ciri aromatik dalam gelang. Lain daripada
benzena, pengikatan pi dalam fosfonitril melibatkan ikatan pi d‑p.
Terdapat dua huraian bagi pengikatan dπ‑pπ
dalam sistem fosfonitril. Craig dan Paddock mencadangkan model berikut:
orbital dxz pada
setiap atom fosforus bertindih dengan orbital pz pada atom nitrogen
bersebelahnya (Rajah 3(a, b)). Disebabkan simetri gerade orbital d, terdapat kurang padanan tanda fungsi gelombang di
dalam trimer. Nod ini mengurangkan kestabilan orbital molekul desetempatan.
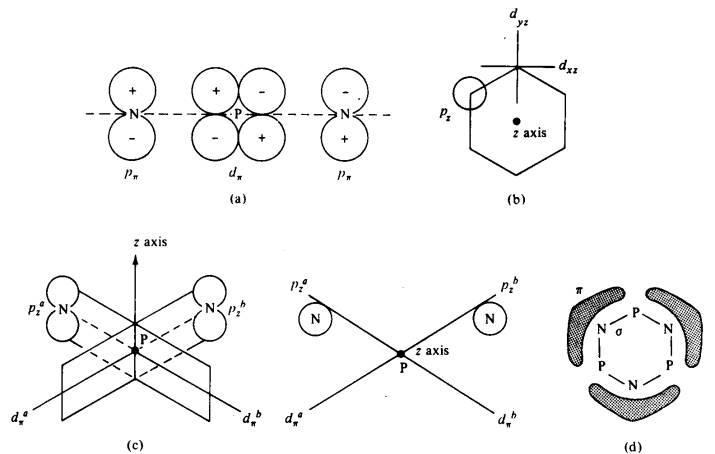
Rajah 3 Pengikatan Pi dalam system fosfonitril . Teori Craig and Paddock: (a) simetri
orbital p(N) dan d(P) yang membentuk ikatan pi ; (b)
konvension yang digunakan bagi orientasi orbital
d pada fosforus. Orbital d berada pada satah yang mengandungi garis lurus. (c)
hubungan orbital ortogonal da dan
db kepada orbital pz nitrogen dilihat bersudut tepat
kepada paksi-z dan selari dengan paksi-z masing-masing; (d) model ikatan pi
tiga-pusat bagi P3N3Cl3 .
Dewar dan rakan sekerja
percaya bahawa kedua-dua orbital dxz dan dyz mengambil
bahagian dalam pengikatan pi. Mereka menghibrid dua orbital ini untuk membentuk
hibrid da dan db
menuju terhadap atom nitrogen di sebelah (Rajah 3(c)). Ini membenarkan ikatan
desetempatan tiga-pusat membentuk pada setiap atom nitrogen (Rajah 3(d)). Skema
ini menyebabkan pendrsetempatan ke atas tembereng tiga-atom terpilih dalam
gelang tetapi terdapat nod pada setiap atom fosforus kerana orbital da dan db atom fosforus adalah
ortogonal kepada satu dengan lain.
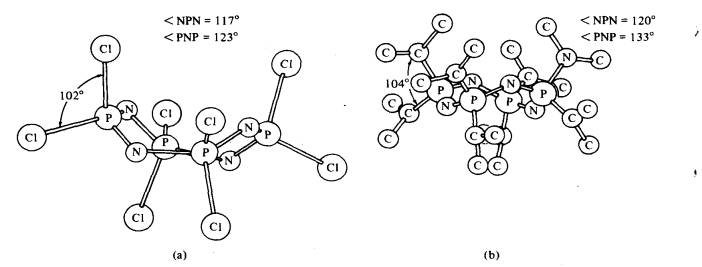
Rajah 4 Fosfonitril tetramerik: (a)
struktur molekul oktaklorotetrafosfonitril (konformasi "tub"); (b)
struktur molekul octakis(dimetilamino)tetrafosfonitril (konformasi
"crown").
Struktur tetramerik fosfonitril adalah lebih anjal daripada yang trimer. Dua konformer: (1) struktur
"tub" bagi fosfonitril klorida tetramerik (Rajah 4(a)); (2) bentuk
"crown" bagi oktametiltetrafosfonitril dan
oktakis(dimetilamino)tetrafosfonitril (Rajah 4(b)). Kedua-dua sebatian adalah
struktur tak bersatah tidak mencegah pendesetempatan dalam gelang. Sebatian organik, siklooktatetraena, C8H8,
adalah bukan aromatik untuk dua sebab: (1) struktur tak bersatah, conformer
"tub" mencegah tindihan pπ‑pπ dengan cekap; (2)
ia tidak mematuhi peraturan Huckel
elektron pi (4n + 2). Peraturan Huckel diformulasikan atas dasar
pengikatan pπ‑pπ dan wujud bagi
sebatian organik siklik dari n = 1 (benzena) ke n = 4 (annulena). Kegunaan
orbital-d mengatasi had peraturan Huckel dan juga membenarkan anjalan lebih
besar gelang kerana orbital d bauran membolehkan pengikatan berlaku di dalam sistem bukan bersatah.
Jika fosforus pentaklorida berlebihan digunakan dalam penyediaan
fosfornitril klorida, polimer linear jenis berikut dapat diasingkan:
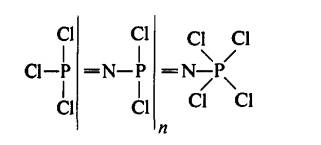
Rajah 5: Struktur polimer linear
(NPCl2)n
Polimer bersifat getah ini dan terbitan berangkai silang sistem gelang
telah menarik perhatian para penyelidik kerana sifat polimer tersebut yang
stabil secara termal pada suhu yang tinggi.
Audrieth dan Sowerby menunjukkan bahawa tindak balas ammonolisis
fosfonitril klorida menghasilkan fosfonitril amida:
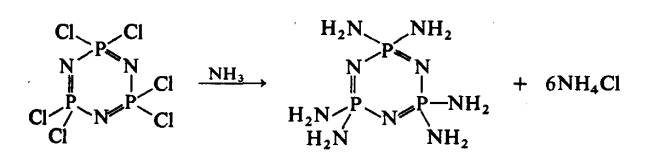
tetapi, ia mengalami penyingkiran ammonia dengan penambahan suhu untuk
menghasilkan rangkai silangan antara gelang (atau kemungkinan pecahan gelang
untuk membentuk polimer linear), akhirnya mendekati stoikiometri (NPNH)n.
Struktur polimer itu tidak diketahui dengan jelas walaupun polimer berat
molekul rendah yang dipercayai sistem tiga gelang telah dipencilkan.
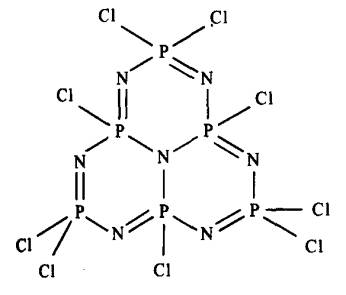
Rajah 6: Struktur andaian Cl2P6N7
Sistem gelang bukan organik heterosiklik
yang lain
Struktur anion silikat siklik
yang diketahui seperti [Si309]6- dan [Si6018]-12
ditunjukkan pada Rajah 7. Anion ini kadang-kadang dirujukkan sebagai "
metasilikat" . Mengikut sistem tatanama lama yang menetapkan orto kepada spesies terhidrat sepenuh (seperti dalam " asid ortosilisik,
Si(OH)4 ") dan meta kepada asid (dan anion) dari mana
1 mol air telah dikeluarkan (seperti “asid metasilisik, OSi(OH)2”)
Rajah 7
Struktur anion “metasilikat”:
(a) trisilikat, [Si309]-6 (b)
heksasilikat, (Si6O18]-2.
Berisoelektron dengan silikat
siklik adalah metafosfat. Ahli yang paling ringkas dalam siri tersebut ialah
anion trimetafosfat, [P309]-3. Anion
tetrametafosfat, [P4012]-4, juga diketahui.
Dengan pemisahan kromatografi
campuran fosfat polimerik dan
metafosfat yang diketahui sebagai garam Graham, kita boleh menunjukkan
kewujudan bukan sahaja tri‑ dan tetrametafosfat, tetapi juga penta‑,
heksa‑, hepta‑, dan oktametafosfat. Pemisahan boleh berlaku
berdasarkan pengetahuan bahawa dua faktor memainkan peranan dalam pergerakan
anion fosfat:
(1) Anion dengan berat molekul tinggi bergerak lebih perlahan daripada ahli
yang lebih rendah dalam siri; (2) sebatian gelang atau anion metafosfat
bergerak lebih cepat dalam larutan berbes daripada anion berantai lurus dengan
kompleksiti setanding (Rajah 8).
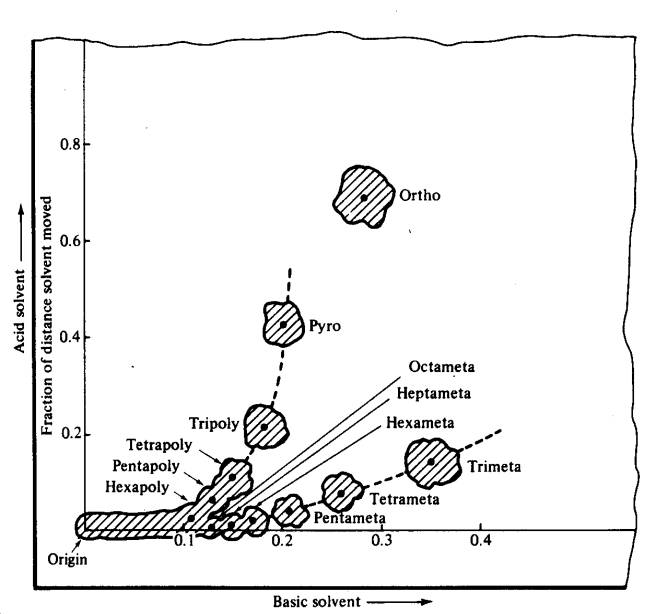
Rajah 8: Pemisahan anion
polifosfat dengan kertas kromatografi. Ion-ion pada mulanya dibenarkan
berhijrah dalam pelarut berbes dan kemudiannya dalam pelarut berasid. Polifosfat berantai lurus berada pada cawangan atas
" Y ", metafosfat, pada
cawangan bawah.
Perkembangan dari silikon ke
fosforus penambahan satu dalam nombor atom menyebabkan penurunan satu cas anion per atom pusat
sepadan dalam gelang itu. Perkembangan selanjutnya dari trimetafosfat ke sulfur
trioksida menyebabkan satu molekul neutral, trimerik sulfur trioksida. Bentuk ini diketahui
sebagai γ‑S03 dan adalah berisoelektron dan berisostruktur dengan
analog anion trimetasilikat dan trimetafosfat. Ia adalah tak stabil secara
termodinamik berbanding dengan dua bentuk lain, β‑S03 yang mengandungi rantai tak terhingga dan α-SO3 yang mungkin mengandungi lapisan tak
terhingga.
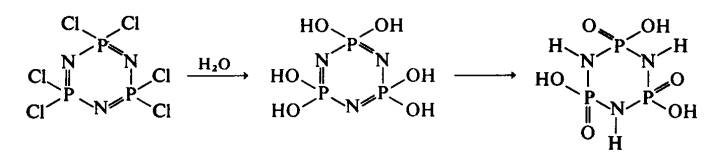
Dalam banyak kes adalah mungkin menyediakan analog ammono di mana kumpulan ‑NH2
dan =NH mengganti ‑OH and =O. Sebelumnya, imidofosfat boleh disediakan
dengan hidrolisis fosfonitril klorida bersama dengan anjakan tautomeric atom
hidrogen untuk membentuk gelang berisostruktur dengan yang dibincang di atas:
Gelang sulfur‑nitrogen
boleh disediakan dengan ammonolisis
sulfuril klorida:
![]()
diikuti dengan deammonasi sulfamida terhasil
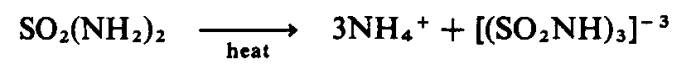
Beberapa garam logam berat
telah disediakan yang antaranya garam perak adalah berguna dalam penyediaan
asid bebas dan terbitan organik:
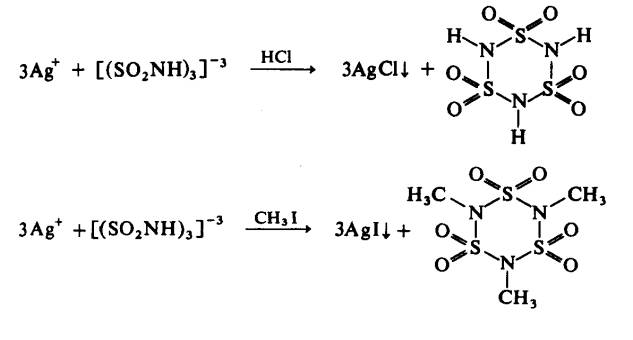
Tetramer yang sepadan dapat disediakan:
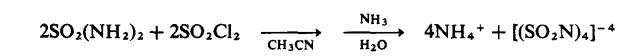
Ammonolisis sulfur monoklorida, S2Cl2, sama ada dalam
larutan pelarut lengai atau dipanaskan atas pepejal ammonium klorida,
menghasilkan tetrasulfur tetranitrida:
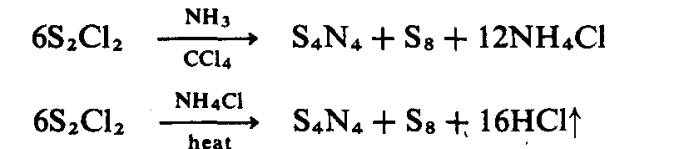
Hasil itu adalah pepejal oren
yang tak larut dalam air tetapi larut dalam beberapa pelarut organik. Walaupun
hablur itu agak stabil terhadap serangan oleh air, ia adalah terlalu sensitif
terhadap kejutan atau geseran.
Struktur S4N4
(Rajah 9(a)) telah didapati mempunyai dua atom sulfur “bukan pengikatan” pada
jarak hanya 258 pm, amat pendek daripada jumlah jejari van der Waals, 360 pm.
Walaupun jarak ini lebih panjang daripada jarak ikatan S‑S
biasa(≈206pm), interaksi mesti berlaku antara atom sulfur transannular.
Semua jarak ikatan S‑N
bond dalam gelang adalah sama (163 pm), menunjukkan pendesetempatan yang luas
berlaku, dan pengikatan tidak dapat diwakili sebagai ikatan tunggal dan dubel
bersilang diskret. Situasi ini adalah serupa dengan tetapi lebih rumit daripada
sistem fosfonitril, dan tafsiran dari segi orbital molekul telah dicadangkan.
Fluorinasi S4N4 menghasilkan
tetratiazil tetrafluorida:

Kehadiran penukargantian fluorin nampak memusnahkan pendesetempatan
elektron dalam gelang kerana jarak ikatan dalam gelang beralternat di antara
ikatan tunggal dan ikatan dubel (Rajah 9(b)).
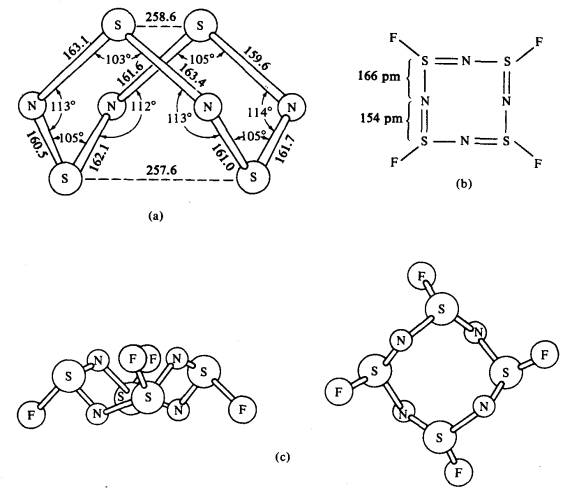
Rajah 9 Gelang lapan-ahli sulfur‑nitrogen:
(a) struktur molekul S4N4; (b) struktur N4S4F4,
menggambarkan jarak ikatan; (c) lukisan perspektif molekul N4S4F4
Penurunan tetrasulfur tetranitrida dengan
timah(II) klorida menghasilkan tetrasulfur tetraimida, S4(NH)4
, berisoelektron dengan sulfur rombus:
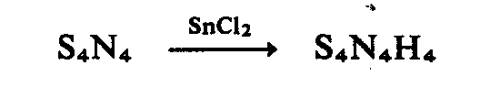
Ia wujud dalam konfigurasi
mahkota. Gelang berisoelektron S‑NH berkaitan, termasuk isomer bagi
pentasulfurtriimida, heksasulfurdiimida, and heptasulfurimida telah diketahui;
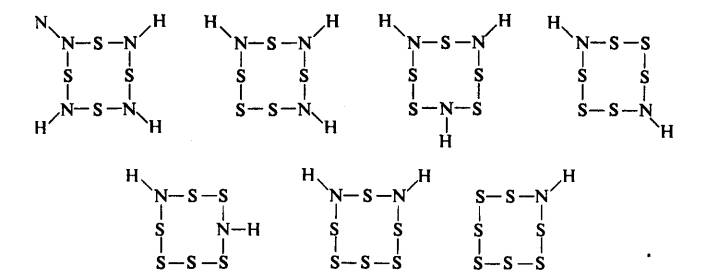
Semua isomer Sx(NH)8-x
adalah diketahui kecuali stuktur
berikatan N‑N.
Gelang enam-ahli S‑N juga diketahui. Pengoksidaan S4N4
dengan klorin menghasilkan
tritiazil triklorida:

Sebatian ini boleh ditukarkan
kepada fluorida yang sepadan atau dioksidakan
kepada sulfanuril klorida:
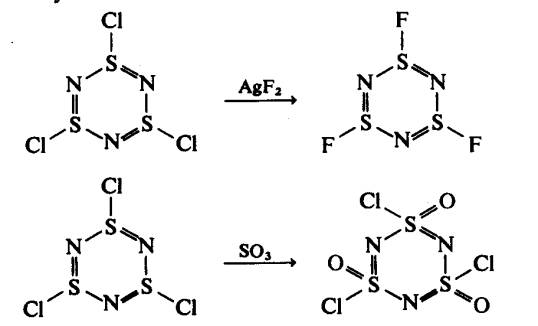
Faktor yang mempengaruhi
kestabilan relatif gelang enam- atau lapan-ahli belum difahami sepenuhnya.
Apabila tiazil fluorida yang
agak tak stabil, NSF, membentuk polimer, hanya trimer, N3S3F3,
terbentuk. Pembentukan klorida trimer menunjukkan kestabilan gelang enam-ahli
digemari. Sebaliknya, penurunan klorida trimer dengan tetrasulfurtetraimida
menyebabkan hanya hasil yang mengandungi gelang lapan-ahli:
![]()
Sistem Takorganik Homosiklik
Beberapa unsur membentuk gelang homosiklik. Sulfur rombus, stabil secara
termodinamik terbentuk pada suhu bilik, mengandungi gelang S8 dalam
konfigurasi mahkota. Modifikasi tak stabil yang mengandungi gelang sulfur
enam-, tujuh, sembilan, sepuluh, dua-belas- dan lapan belas-ahli juga
diketahui. Selenium juga membentuk gelang lapan-ahli tetapi ia tak stabil
berbanding dengan bentuk rantai.
Pengoksidaan beberapa bahan bukan logam dalam sistem berasid kuat menghasilkan
spesies kation poliatom jenis am Ynm+. Antara ion yang
telah dicirikan dengan baik adalah ion S42+, Se42+,
dan Te42+:
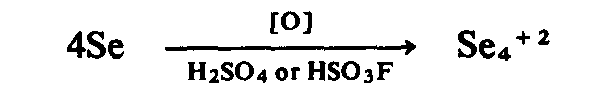
Struktur ion Se42+ telah ditentukan sebagai satah
persegi
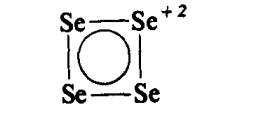
dan mungkin ketiga-tiga spesis mempunyai struktur sama, distabilkan dengan
elektron pi Huckel. Ion lain jenis ini, diandaikan siklik, S4+
, S8+2, S16+2, Sb4+2,
Sb8+2, Sbn+n, Te4+4, dan Te6+2,
telah dicadangkan sebagai hasil tindak balas pengoksidaan unsur tertentu dalam
keadaan asid yang kuat.
Beberapa siklopolifosfin
adalah diketahui. Penurunan trifluorometilfosforus halida
(X = Br, I) menyebabkan amaun
sama sebatian empat- dan lima-ahli:
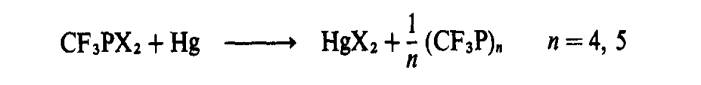
Sebatian serupa boleh didapati dengan penyingkiran hidrogen klorida:

Walaupun pentafenilsiklopentafosfin dan heksafenilsikloheksafosfin adalah
diasingkan daripada tindak balas tersebut, terdapat bukti bahawa dalam larutan
kedua-dua bentuk wujud sebagai tetramer. Alkilsiklopolifosfin yang lain, (RP)n,
dengan R= CH3, C2H5, C3H7,
C4H9 djketahui
wujud. Arsenik juga diketahui membentuk
beberapa gelang homosiklik seperti (CF3As)4, (CH3As)5,
and (fAs)5 .
Pengoksidaan fosforus merah dengan
hipohalit dalam larutan beralkali menghasilkan anion asid fosforus :

Asid tersebut telah ditentukan sebagai siklik dengan struktur:
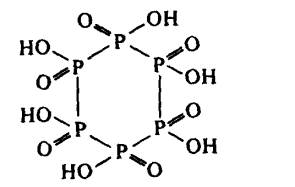
Terdapat satu siri anion
oksokarbon dengan formula am [(CO)n]-2,-4 (Rajah 10). Ion
krokonat, C5O5-2, adalah ahli pertama siri
yang disintesis.
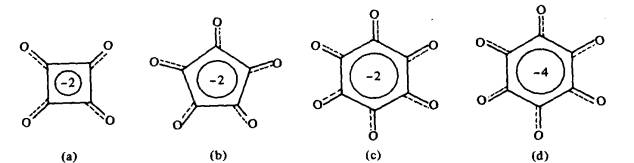
Rajah 10 Anion siklik oksokarbon : (a) skuarat; (b) krokonat;
(c) rodizonat; (d) tetraanion tetrahidroquinon.
Dari pandangan sejarah
perkara berikut adalah menarik: (1) Ia diasingkan pada 1825 oleh Gmelin dan
oleh itu berkongsi dengan benzena (diasingkan daripada tar batu arang oleh
Faraday pada tahun yang sama) sebagai sebatian aromatik pertama dijumpai. (2)
Ia adalah bahan takorganik aromatik pertama yang dijumpai.
(3) Ia adalah hasil metabolik
bakteria dan sebatian organik pertama yang disintesis, tiga tahun sebelum
Wöhler mensintesis urea.
Semua anion oksokarbon adalah
aromatik mengikut penghitungan orbital molekul. Penstabilan aromatik anion
adalah alasan bagi fakta bahawa asid skuarik (H2C404)
adalah sama kuat seperti asid sulfurik.